Hyvän vastauksen piirteet: FI – Kemia
25.3.2022
Lopulliset hyvän vastauksen piirteet 17.5.2022
Lopullisista hyvän vastauksen piirteistä ilmenevät perusteet, joiden mukaan koesuorituksen lopullinen arvostelu on suoritettu. Tieto siitä, miten arvosteluperusteita on sovellettu kokelaan koesuoritukseen, muodostuu kokelaan koesuorituksestaan saamista pisteistä, lopullisista hyvän vastauksen piirteistä ja lautakunnan määräyksissä ja ohjeissa annetuista arvostelua koskevista määräyksistä. Lopulliset hyvän vastauksen piirteet eivät välttämättä sisällä ja kuvaa tehtävien kaikkia hyväksyttyjä vastausvaihtoehtoja tai hyväksytyn vastauksen kaikkia hyväksyttyjä yksityiskohtia. Koesuorituksessa mahdollisesti olevat arvostelumerkinnät katsotaan muistiinpanoluonteisiksi, eivätkä ne tai niiden puuttuminen näin ollen suoraan kerro arvosteluperusteiden soveltamisesta koesuoritukseen.
Ylioppilastutkinnon kokeessa selvitetään, ovatko opiskelijat omaksuneet lukion opetussuunnitelman mukaiset tiedot ja taidot sekä saavuttaneet lukiokoulutuksen tavoitteiden mukaisen riittävän kypsyyden. Kemian kokeessa arvioinnin kohteina ovat kemiallisen tiedon ymmärtäminen ja soveltaminen. Arvioinnissa otetaan huomioon myös kokeellisen tiedonhankinnan ja ‐käsittelyn taidot. Näihin kuuluvat esimerkiksi kokeiden suunnittelu, työvälineiden ja reagenssien turvallinen käyttö, tulosten esittäminen ja tulkitseminen sekä johtopäätösten tekeminen ja soveltaminen.
Kemian tehtäviä arvosteltaessa painotetaan oppiaineen luonteen mukaista esitystapaa sekä käsitteiden ja kielenkäytön täsmällisyyttä. Reaktioyhtälöt esitetään ilman hapetuslukuja pienimmin mahdollisin kokonaislukukertoimin ja olomuodoilla varustettuna. Orgaanisissa reaktioyhtälöissä käytetään rakennekaavoja, mutta olomuotoja ei tarvitse mainita. Rakennekaavojen eri esitystavat hyväksytään.
Laskennallisissa tehtävissä suureyhtälöjä ja kaavoja käytetään tavalla, joka osoittaa kokelaan ymmärtäneen tehtävänannon oikein ja soveltaneen ratkaisussaan asianmukaista periaatetta tai lakia. Vastauksesta ilmenee yksiselitteisesti, miten lopputulokseen päädytään, mutta laajoja välivaiheita ei tarvita. CAS-ohjelmia voi hyödyntää tehtävän eri vaiheissa. Merkintätapojen kannalta keskeisiä vaiheita ovat periaatteiden ja lakien sekä lopputuloksen ja johtopäätösten esittäminen. Lopputulokset annetaan lähtöarvojen mukaisella tarkkuudella yksiköineen ja johtopäätökset perustellaan.
Mittaustuloksia ja niistä piirrettyjä kuvaajia hyödynnetään tiedon analysoinnissa ja johtopäätösten tekemisessä. Mittauspisteisiin sovitetaan asianmukainen suora tai käyrä esimerkiksi jonkin sovitefunktion avulla. Jos mittauspisteet ovat lähellä toisiaan, varsinaista sovitefunktiota ei tarvitse lisätä. Mittauspisteiden välisiä arvoja voi interpoloida kuvaajaa silmämääräisesti lukemalla tai sopivalla ohjelmalla. Kuvaajaan merkitään akselien nimet, yksiköt ja asteikko. Kuvaajaan merkitään johtopäätösten kannalta olennaiset kohdat, kuten titrauskäyrän ekvivalenttikohta tai hetkellistä nopeutta laskettaessa kyseinen tangentti.
Essee‐ ja selittävissä vastauksissa tekstiä täydennetään reaktioyhtälöillä, kaavoilla tai piirroksilla. Käsiteltäviä ilmiöitä kuvataan makroskooppisella, mikroskooppisella ja symbolisella tasolla. Vastauksesta ilmenee, että tehtävään liittyvää aineistoa on hyödynnetty, sovellettu, analysoitu ja arvioitu tehtävänannon mukaisesti. Hyvä vastaus on jäsennelty ja sisällöltään johdonmukainen.
Vastaus arvostellaan tehtäväkohtaisten kriteerien mukaisesti. Lähtökohtana ovat vastauksen ansiot, joista kertyy pisteitä. Jos keskeinen kemiallinen periaate puuttuu tai se on virheellinen, pisteiden kertyminen päättyy. Tällöin virheellisen tuloksen siirtymistä eteenpäin ei hyväksytä (ei-VSE). Muiden puutteiden tai virheiden tapauksessa virheellisen tuloksen siirtyminen eteenpäin hyväksytään (VSE), jolloin pisteiden kertyminen jatkuu puutteen tai virheen jälkeen. Kokeen loppupään vaativat tehtävät edellyttävät täsmällisempää periaatteiden hallintaa kuin kokeen alkupään perustehtävät. Kemian kannalta epätäsmällisestä kielenkäytöstä, pienestä laskuvirheestä tai likiarvojen huolimattomasta käytöstä vähennetään 0–3 p.
Osa 1: 20 pisteen tehtävä
1. Monivalintatehtäviä kemian eri osa-alueilta 20 p.
1.1 NaCl(aq)-liuos on 2 p.
- homogeeninen seos. (2 p.)
1.2 Minkä yhdisteen sidoksissa on eniten ioniluonnetta? 2 p.
- KH (2 p.)
1.3 Mikä seuraavista sidoksista on vetysidos? 2 p.
- NH₃-molekyylien välinen sidos (2 p.)
1.4 Eräs reniumin kloridisuola sisältää 63,6 massaprosenttia reniumia. Mikä on kyseisen suolan suhdekaava (empiirinen kaava)? 2 p.
- ReCl₃ (2 p.)
1.5
Sähkökemiallisen parin toisena elektrodina on Ag-levy Ag+(aq)-liuoksessa ja toisena elektrodina Pt-levy S2O82–(aq)-liuoksessa. Pelkistyspotentiaalit ovat
\begin{align}
\mathrm{Ag^+\left(aq\right)\ +\ e^-\ \rightarrow\ Ag\left(s\right)} && E^{\circ}\ =\ 0{,}80\ \mathrm{V} \\
\mathrm{S_2O_8^{2-}\left(aq\right)\ +\ 2e^-\ \rightarrow\ 2\ SO_4^{2-}\left(aq\right)} && E^{\circ}\ =\ 2{,}01\ \mathrm{V}
\end{align}
Mikä on muodostuneen parin lähdejännite?
2 p.
- 1,21 V (2 p.)
1.6 Vesiliuos sisältää Au+-, Co2+-, Mg2+- ja Sn2+-ioneja, joista kunkin konsentraatio on 1,0 mol/dm3. Liuosta elektrolysoidaan siten, että jännitettä lisätään vähitellen. Missä järjestyksessä metallit saostuvat katodille? 2 p.
- Au, Sn, Co; sen sijaan Mg ei saostu (2 p.)
1.7 Miten tuntemattoman proteiinin kolmiulotteinen rakenne voidaan selvittää? 2 p.
- röntgenkristallografialla (2 p.)
1.8 Järjestä seuraavat nesteiden mittaamiseen käytetyt välineet tarkimmasta epätarkimpaan, kun mitattava tilavuus on 25,0 ml: dekantterilasi, mittapipetti, mittalasi, täyspipetti. 2 p.
- täyspipetti, mittapipetti, mittalasi, dekantterilasi (2 p.)
1.9 Alla oleva kuvaaja esittää katalysoituun reaktioon osallistuvien aineiden konsentraatiot c ajan t funktiona. Mikä käyristä esittää vapaan (lähtöaineeseen tai tuotteeseen sitoutumattoman) katalyytin konsentraatiota? 2 p.
- B (2 p.)
1.10 Kuinka paljon seuraavassa reaktiossa vapautuu tai sitoutuu lämpöä reaktioon osallistuvien aineiden muodostumislämpöjen perusteella, kun yksi mooli Fe₂O₃(s):a reagoi? 2 p.
- Lämpöä vapautuu 26,8 kJ. (2 p.)
Osa 2: 15 pisteen tehtävät
2. Rikkihapon valmistus 15 p.
2.1 Kirjoita kokonaisreaktion reaktioyhtälö. 5 p.
Kokonaisreaktio saadaan laskemalla peräkkäiset reaktiot yhteen.
Pisteitys:
- väärä kokonaisreaktioyhtälö mutta kerrottu reaktioyhtälöt oikeilla luvuilla, 0–2 p.
- oikea kokonaisreaktioyhtälö 5 p.
- aine sieventämättä kokonaisreaktioyhtälöstä, −1 p./aine
4FeS₂(s) + 11O₂(g) → 2Fe₂O₃(s) + 8SO₂(g)
2SO₂(g) + O₂(g) → 2SO₃(g) │· 4
SO₃(g) + H₂SO₄(aq) → H₂S₂O₇(aq) │· 8
H₂S₂O₇(aq) + H₂O(l) → 2H₂SO₄(aq) │· 8
Tästä saadaan:
4FeS₂(s) + 11O₂(g) → 2Fe₂O₃(s) + 8SO₂(g)
8SO₂(g) + 4O₂(g) → 8SO₃(g)
8SO₃(g) + 8H₂SO₄(aq) → 8H₂S₂O₇(aq)
8H₂S₂O₇(aq) + 8H₂O(l) → 16H₂SO₄(aq)
Kokonaisreaktio:
4FeS₂(s) + 15O₂(g) + 8H₂O(l)→ 2Fe₂O₃(s) + 8H₂SO₄(aq)
2.2 Kuinka monta kilogrammaa rikkihappoa muodostuu, jos käytössä on 3 755 kg pyriittiä FeS₂ ja muodostuvan rikkihapon oletetaan olevan 100-massaprosenttista? Kuinka monta kilogrammaa 95-massaprosenttista rikkihappoa voidaan valmistaa tästä rikkihappomäärästä? 7 p.
n(FeS₂) = m / M = 3 755 000 g / (119,99 g/mol) = 31 294,2745 mol
(2 p.)
n(H₂SO₄) = 2 · n(FeS₂) = 62 588,549 mol
(2 p.)
m(H₂SO₄)100 % = n · M = 62 588,549 mol · 98,086 g/mol = 6 139 060 g ≈ 6 139 kg
(1 p.)
m(H₂SO₄)95 % = m(H₂SO₄)100 % / 0,95 = 6 139 060 g / 0,95 = 6 462 169 g ≈ 6 462 kg
(2 p.)
2.3 Laboratoriossa 95-massaprosenttisesta rikkihaposta valmistetaan laimea liuos, jonka konsentraatio on 1,00 mol/l. Mitä työturvallisuustekijöitä työssä on huomioitava? Perustele vastauksesi. 3 p.
Rikkihappo on syövyttävä neste. (1 p.)
Kun sitä käsitellään, on käytettävä suojalaseja, -hansikkaita ja -takkia. (1 p.)
Liuoksen valmistus on turvallisinta tehdä vetokaapissa.
TAI
Kun happoa laimennetaan, mittapullon pohjalle laitetaan roiskahduksien ehkäisemiseksi ensin hieman vettä ja rikkihappo pipetoidaan vasta sen jälkeen. (1 p.)
3. Tuntematon kemikaalijäte 15 p.
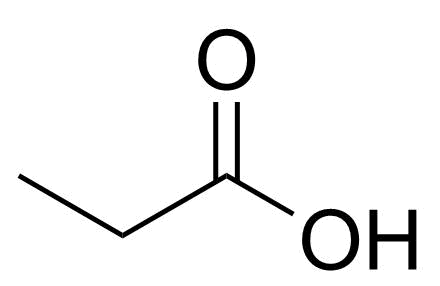
3.1 Yhdisteellä C₃H₆O₂ on yksi rakenneisomeeri, joka voi muodostaa selvästi happaman vesiliuoksen. Piirrä tämän rakenneisomeerin rakennekaava. 2 p.
3.2 Piirrä kaikki ne yhdisteen C₃H₆O₂ rakenneisomeerit, joissa on esteriryhmä. 4 p.
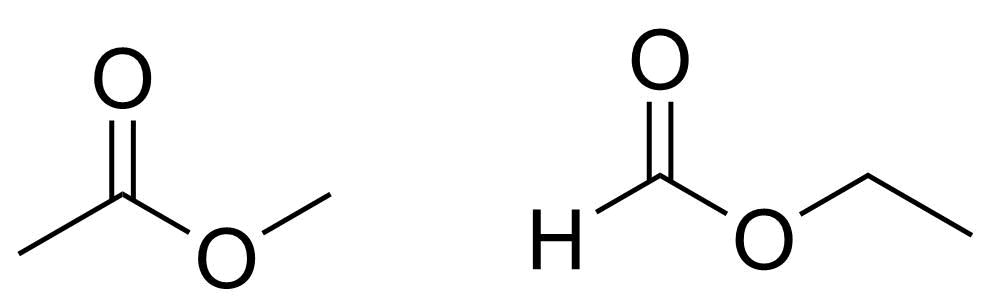 Metyylietanaatin H₃CCOOCH₃ ja etyylimetanaatin HCOOC₂H₅ rakenteet
Metyylietanaatin H₃CCOOCH₃ ja etyylimetanaatin HCOOC₂H₅ rakenteet
2 p./rakenne
- ylimääräinen väärä rakenne, −2 p./rakenne
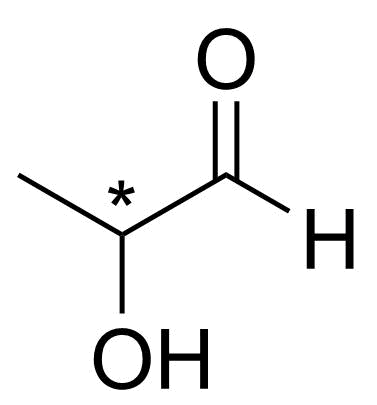
3.3 Piirrä kaikki ne yhdisteen C₃H₆O₂ rakenneisomeerit, jotka voivat hapettua siten, että molekyyliin syntyy aldehydiryhmä. 4 p.
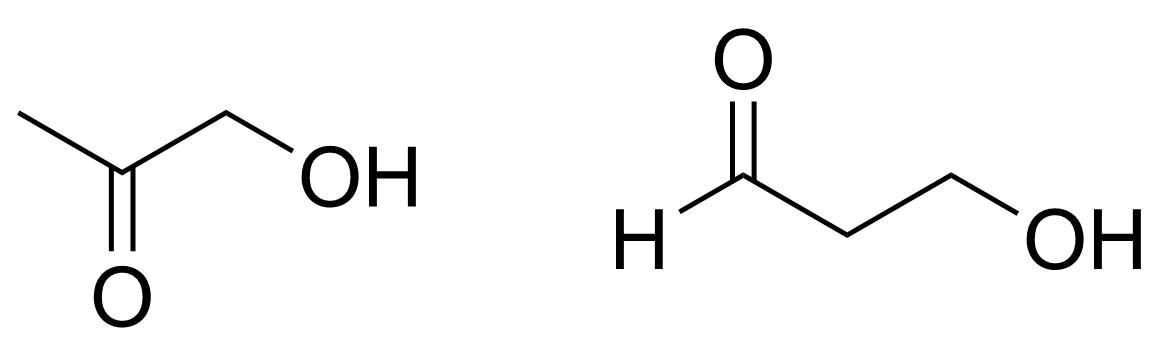 1-hydroksipropan-2-onin H₃CCOCH₂OH ja 3-hydroksipropanaalin OHCCH₂CH₂OH rakenteet
1-hydroksipropan-2-onin H₃CCOCH₂OH ja 3-hydroksipropanaalin OHCCH₂CH₂OH rakenteet
2 p./rakenne
- ylimääräinen väärä rakenne, −2 p./rakenne
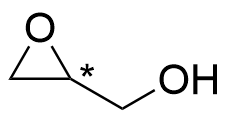
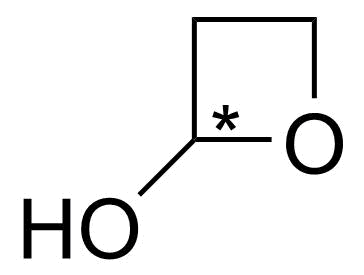
3.4 Piirrä yksi yhdisteen C₃H₆O₂ rakenneisomeeri, jossa on asymmetriakeskus. Merkitse asymmetriakeskus rakennekaavaan esimerkiksi tähdellä. 3 p.
tai
tai
Kuvat: Mahdollisia isomeereja, joissa on asymmetriakeskus (alin rakenne on pysymätön).
Rakenne 2 p., asymmetriakeskus merkitty oikein 1 p.
3.5 Mitä merkintöjä tutkijan olisi pitänyt tehdä kemikaalijätepulloon? 2 p.
Jätepullossa on oltava merkintä ”jäte”. Jätteen koostumus tulee kuvata. (1 p.) Pulloon on liitettävä myös pullon sisältämän jätekemikaalin varoitusmerkit. (1 p.)
(Jätepullossa on oltava myös jätteen tuottajan nimi ja päivämäärä.)
4. Synteesin materiaalitehokkuus ja ympäristökuormitus 15 p.
4.1 Aineistossa on kuvattu butyyliasetaatin synteesi. Laske butyyliasetaatin prosentuaalinen saanto. 4 p.
Lasketaan reaktion rajoittava tekijä:
n(CH₃(CH₂)₃OH) = m / M = 37,0 g / (74,12 g/mol) = 0,49919 mol
n(CH₃CO₂H) = m / M = 60,0 g / (60,052 g/mol) = 0,99913 mol
(1 p.)
Butan-1-oli ja etikkahappo reagoivat moolisuhteessa 1:1.
→ Butan-1-oli on reaktion rajoittava tekijä.
(1 p.)
nteor(butyyliasetaatti) = n(CH₃(CH₂)₃OH) = 0,49919 mol
mteor(butyyliasetaatti) = nteor(butyyliasetaatti) · M(butyyliasetaatti)
= 0,49919 mol · 116,156 g/mol = 57,984 g
(1 p.)
saanto-% = (todellinen saanto) / (teoreettinen saanto) = 40,0 g / (57,984 g) = 0,6898 eli saanto-% on 69,0 %.
(1 p.)
4.2 Laske butyyliasetaatin synteesin atomiekonomia (AE, %) käyttäen apuna aineistoja ja . Ilmoita vastaus kolmen merkitsevän numeron tarkkuudella. 3 p.
AE, % = ν(tuote) · M(tuote) / (Σνi · Mi)
AE, % = (116,56 g/mol) / (74,12 g/mol + 60,052 g/mol) = (116,156 g/mol) / (134,172 g/mol)
(2 p.)
= 0,8657 eli 86,6 %
(1 p.)
4.3 Laske butyyliasetaatin synteesin ympäristötekijä (E-tekijä) käyttäen apuna aineistoja ja . 3 p.
E-tekijä = (reaktiossa muodostuvien jätteiden ja sivutuotteiden massojen summa) / (puhdistetun lopputuotteen massa)
E-tekijä = (250 g + 125 g + 25,0 g + 5,0 g + 37,0 + 60,0 − 40,0 g) / (40,0 g) = (462 g) / (40,0 g) = 11,55 ≈ 11,6
Pisteitys: nimittäjä oikein, 1 p.; osoittaja oikein 1 p.; vastaus oikein 1 p.
4.4
Mitkä ovat prosentuaalisen saannon, atomiekonomian ja ympäristötekijän arvot täysin ihanteellisessa kemiallisessa synteesissä?
Arvioi aineistossa kuvatun butyyliasetaatin synteesireaktion materiaalitehokkuutta ja ympäristökuormitusta kohtien 4.1–4.3 tulosten ja synteesin reaktioyhtälön perusteella.
5 p.
Arvot täysin ihanteellisessa kemiallisessa synteesissä (1 p., kun kaikki kolme arvoa ovat oikein):
saanto-% = 100
AE, % = 100
E-tekijä = 0
Butyyliasetaatin synteesireaktion materiaalitehokkuus ja ympäristökuormitus (enintään 4 p. alla olevasta korista; 1 p./perustelu)
Saantoarvon analyysi
- Huomattu, että kyseessä on tasapainoreaktio ja siihen nähden saantoprosentti (69,0 %) on kohtuullinen.
- Jos reaktio toteutettaisiin teollisuudessa, 31,0 %:n tuotemenetys tarkoittaisi, että suuri määrä lähtöaineita tai tuotetta menee hukkaan.
Atomiekonomia-arvon analyysi
- Sivutuotteena muodostuu vain vettä, joka on pienimolekyylinen aine. Veden kerroin synteesin reaktiossa on 1. Siten sivutuotteen osuus on pieni, jolloin atomiekonomia on hyvä/lähellä maksimia.
Ympäristötekijä-arvon analyysi
- Jätettä muodostui erityisesti reaktiotuotteen erotus- ja puhdistusvaiheissa (vesi ja pesuliuokset).
- Vaikka jätteen määrä oli melko suuri, suurin osa siitä oli vesiliuoksia.
Yleiset huomiot reaktioyhtälön aineiden turvallisuudesta tai synteesin energiankulutuksesta
- Ympäristökuormitusta arvioitaessa tulisi huomioida myös energiankulutus ja se, miten energia tuotetaan. Lasketut suureet eivät kuvaa tätä.
5. Fysiologinen suolaliuos 15 p.
5.1
Piirrä taulukon mittaustulosten perusteella standardisuoran kuvaaja ja määritä sen yhtälö.
Ihmisten suonensisäiseen nesteyttämiseen käytetään fysiologista suolaliuosta, joka sisältää 4,50 grammaa natriumkloridia 500,0 ml:n kokonaistilavuudessa. Mikä on fysiologisen suolaliuoksen sähkönjohtavuus?
7 p.
Kuvakaappaus GeoGebra-ohjelmasta:
(2 p.)
Standardisuoran yhtälö on
κ = (102,5 (mS · dm³)/(cm · mol)) · c(NaCl) – 0,2500 mS/cm.
(1 p.)
Vastauksessa ei vaadita yksiköitä. Pakotus nollaan on pieni periaatevirhe, josta ei seuraa pistevähennystä.
n(NaCl) = m / M = 4,50 g / 58,44 g/mol = 0,077002 mol
(1 p.)
c(NaCl) = n / V = 0,077002 mol / 0,5000 dm³ = 0,15400 mol/dm³
(1 p.)
Konsentraation sijoitus suoran yhtälöön tai sähkönjohtavuuden lukeminen kuvaajasta (määritystapa on käytävä ilmi esim. pisteenä tai viivana kuvasta):
κ = (102,5 (mS · dm³)/(cm · mol)) · c(NaCl) – 0,2500 mS/cm
(1 p.)
= 102,5 (mS · dm³)/(cm · mol) · 0,15400 mol/dm³ – 0,2500 mS/cm
= 15,535 mS/cm ≈ 15,5 mS/cm
(1 p.)
5.2 Mitä tapahtuu, jos suonensisäiseen nesteyttämiseen käytetään fysiologista suolaliuosta laimeampaa tai väkevämpää liuosta? 4 p.
Osmoosi tarkoittaa, että liuotin/vesi siirtyy laimeammasta liuoksesta väkevämpään siten, että pitoisuuserot tasoittuvat.
(2 p.)
Jos suonensisäiseen nesteyttämiseen käytettäisiin fysiologista suolaliuosta laimeampaa liuosta, vettä siirtyisi veriplasmasta soluihin.
(1 p.)
Tästä veden osmoottisesta virtauksesta voisi seurata solujen laajeneminen ja jopa hajoaminen, esimerkiksi hemolyysi eli punasolujen hajoaminen.
(1 p., edellyttäen, että edellinen piste on ansaittu)
Jos suonensisäiseen nesteyttämiseen käytettäisiin fysiologista suolaliuosta väkevämpää liuosta, vesi siirtyisi soluista veriplasmaan.
(1 p.)
Tällöin esimerkiksi punasolut kutistuisivat.
(1 p., edellyttäen, että edellinen piste on ansaittu)
5.3 Natriumkloridiliuosta käytetään usein standardiliuoksena johtokykymittarien kalibroinnissa. Tätä varten valmistettiin 25 ml:n mittapulloon standardiliuos, jonka sähkönjohtavuus oli 20,0 mS/cm. Työssä valmistettiin ensin 100 ml:n mittapulloon NaCl:n kantaliuos, jonka konsentraatio oli 2,00 mol/l. Kuinka suuri tilavuus kantaliuosta oli pipetoitava 25 ml:n mittapulloon? 4 p.
cstd-liuos = (κ + 0,2500 mS/cm) / (102,5 (mS · dm³)/(cm · mol))
= (20,0 mS/cm + 0,2500 mS/cm) / (102,5 (mS · dm³)/(cm · mol)) = 0,197561 mol/l
(1 p.)
cstd-liuos · Vstd-liuos = ckantaliuos · Vkantaliuos
Vkantaliuos = cstd-liuos · Vstd-liuos / ckantaliuos
= 0,197561 mol/ dm³ · 0,025 dm³ / (2,00 mol/ dm³)
(2 p.)
= 2,469512 · 10–3 dm³
≈ 2,47 ml
(1 p.)
6. Hajuaistin hyödyntäminen titrauksessa 15 p.
6.1 Päättele, mikä on tämän titrauksen pH-arvo ekvivalenttipisteessä. Perustele vastauksesi. 2 p.
Titrauksen ekvivalenttipisteessä pH on 7, (1 p.) koska kyseessä on vahvan emäksen ja vahvan hapon reaktio. (1 p.)
6.2 Mikä oli putkenavaajaliuoksen pH-arvo? 6 p.
Titrauksessa tapahtuva reaktio:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
n(HCl) = c(HCl) · V(HCl) = 0,200 mol/l · 0,0177 l = 0,00354 mol
(1 p.)
Reaktioyhtälön mukaan n(NaOH) = n(HCl)
(1 p.)
c(NaOH) = n(NaOH) / V(NaOH) = 0,00354 mol / 0,0100 l = 0,354 mol/l
(1 p.)
- jos jaettu tilavuudella 17,7 ml, eli ekvivalenttipisteen tilavuudella, ei-VSE pH:n laskuosuuteen ja tehtävästä maks. 2 ensimmäistä pistettä.
[OH⁻] = c(NaOH) = 0,354 mol/l
pOH = −lg[OH⁻] = −lg[0,354 mol/l] = 0,451
(1 p.)
pH = 14,00 – 0,451 = 13,549 ≈ 13,55
(2 p.)
6.3 Millä edellytyksillä hajun muutosta voidaan hyödyntää titrauksessa? Pohdi asiaa ekvivalenttipisteen havaitsemisen ja titrauksen käytännön suorituksen kannalta. 4 p.
Ekvivalenttipisteen havaitsemiseen ja titrauksen käytännön suoritukseen vaikuttavista seikoista yhteensä enintään 4 p.:
- Indikaattori reagoi titrauksen ekvivalenttipisteessä.
Tai
- Haju erottuu selvästi heti titrauksen ekvivalenttipisteessä.
Tai
- Hajua muodostava reaktio ei ala ennen ekvivalenttipistettä.
(2 p.) - Mikään titraukseen osallistuvista aineista ei saa olla hengitettynä terveydelle haitallinen. / Indikaattorikaasu ei ole myrkyllinen tai haitallinen. (2 p.)
Muita järkeviä selityksiä, max 1 p., esimerkiksi
- Haju on aistittavissa vähintään muutaman sekunnin.
- Haju ei ole hajuaistia turruttava.
- Indikaattorin aiheuttama haju ei ole liian voimakas tai epämiellyttävä.
- Titraus on menetelmänä toistettava.
6.4 Ekvivalenttipisteessä havaittava haju aiheutuu disulfidista ja tiosulfonaatista. Nämä yhdisteet muodostuvat aineistossa kuvatuissa reaktioissa. Mikä on allinaasin rooli reaktiossa A? Mitkä ovat reaktioiden B ja C reaktiotyypit? 3 p.
Allinaasi on entsyymi/katalyytti, joka nopeuttaa reaktiota. (1 p.)
B: kondensaatioreaktio (1 p.)
C: hapettumis-pelkistymisreaktio (1 p.)
7. Ksenonin yhdisteet 15 p.
7.1 Kiinteä ksenondifluoridi reagoi hitaasti veden kanssa. Reaktiossa muodostuu ksenonia, happea ja vetyfluoridia. Kirjoita tätä reaktiota kuvaava reaktioyhtälö. Miten atomien hapetusluvut muuttuvat reaktiossa? 5 p.
2XeF2(s) + 2H2O(l) → 2Xe(g) + 4HF(aq) + O2(g)
(3 p.)
- oikeat aineet 1 p.
- oikeat kertoimet 1 p. (edellyttäen, että aineet ovat oikein)
- oikeat olomuodot 1 p. (edellyttäen, että aineet ovat oikein)
| Alkuaine | Alussa | Lopussa |
|---|---|---|
| Xe | +2 | 0 |
| F | –1 | –1 |
| H | +1 | +1 |
| O | –2 | 0 |
(2 p.)
- hapen hapetusluvun muutos 1 p.
- ksenonin hapetusluvun muutos 1 p.
- jos vedyn tai fluorin hapetusluvut muuttuvat, −1 p./aine
7.2 Ksenon muodostaa ksenonhappoa H₂XeO₄, jonka suoloja kutsutaan ksenaateiksi. Kiinteä natriumvetyksenaatti NaHXeO₄ reagoi natriumhydroksidin vesiliuoksen kanssa, jolloin muodostuu vesiliukoista natriumperksenaattia Na₄XeO₆ ja ksenonkaasua. Reaktiossa muodostuu myös happea ja vettä. Kirjoita tätä reaktiota kuvaava reaktioyhtälö. Miten atomien hapetusluvut muuttuvat reaktiossa? 6 p.
2NaHXeO4(s) + 2NaOH(aq) → Na4XeO6(aq) + Xe(g) + O2(g) + 2H2O(l)
(3 p.)
- oikeat aineet 1 p.
- oikeat kertoimet 1 p. (edellyttäen, että aineet ovat oikein)
- oikeat olomuodot 1 p. (edellyttäen, että aineet ovat oikein)
| Alkuaine | Alussa | Lopussa |
|---|---|---|
| Na | +1 | +1 |
| H | +1 | +1 |
| Xe | +6 | +8 ja 0 |
| O | –2 | –2 ja 0 |
(3 p.)
- hapen hapetusluvun muutos 1 p.
- ksenonin hapetuslukujen muutokset 1 p. + 1 p.
- jos vedyn tai fluorin hapetusluvut muuttuvat, −1 p./aine
Myös vastaus 6NaHXeO4(s) + 2NaOH(aq) → 2Na4XeO6(aq) + 4Xe(g) + 5O2(g) + 4H2O(l) hyväksytään.
7.3 Helium ja neon eivät muodosta pysyviä yhdisteitä. Ksenon taas muodostaa useita pysyviä yhdisteitä, joissa se esiintyy kationina. Miksi ksenon muodostaa helpommin kationeja kuin helium ja neon? 4 p.
Kationin muodostus:
Elektronin luovutus käy ilmi: Kationin muodostumisessa on kyse ionisoitumisesta / Kationi muodostuu atomin hapettuessa/luovuttaessa (ulko)elektronin/elektroneja / Kationi on positiivisesti varautunut ioni.
(1 p.)
Perusteluosuus:
Ionisaatioenergia pienenee ryhmässä alaspäin siirryttäessä. / Ksenonin ionisaatioenergia on pienempi kuin heliumin ja neonin.
Pienempi ionisaatioenergia johtuu siitä, että ksenonin ulkoelektronit ovat kauempana ytimestä / ytimen ja ulkokuoren välissä on enemmän elektronikuoria.
(2 p.)
TAI
Ksenonilla on enemmän elektronikuoria. / Ksenonin ulkoelektronit sijaitsevat kauempana ytimestä.
Tällöin (positiivisen) ytimen vetovoima elektroneihin on heikompi / elektronien väliset hylkimisvoimat ovat suuremmat.
(2 p.)
Johtopäätös:
Siksi ulkoelektronit ovat heikommin sitoutuneita / irtoavat helpommin ksenonilta kuin heliumilta tai neonilta.
(1 p., edellyttäen, että jokin edeltävä piste on ansaittu)
8. Vesikaasun siirtoreaktio 15 p.
8.1 Perustele aineiston avulla, onko siirtoreaktio eksoterminen vai endoterminen. 3 p.
Kuvaajan ja taulukon tulkinta:
Reaktion tasapainovakio K kasvaa, kun lämpötila pienenee.
(1 p.)
Perusteltu tasapainotilan siirtyminen endotermiseen suuntaan lämpötilan kasvaessa tai tasapainotilan siirtyminen eksotermiseen suuntaan lämpötilan laskiessa.
TAI
Tunnistettu tasapainovakion lausekkeen nimittäjän kasvaminen ja/tai osoittajan pieneneminen.
TAI
Selitetty tasapainotilan siirtyminen Le Chatelier’n periaatteen avulla.
(1 p.)
Reaktio on eksoterminen.
(1 p., edellyttäen, että jokin edeltävä piste on ansaittu)
8.2 Tutkittava seos on suljetussa 5,00 litran astiassa ja sisältää 0,019 moolia hiilimonoksidia, 0,52 moolia vettä, 0,95 moolia hiilidioksidia ja 0,95 moolia vetyä lämpötilassa 500 K. Osoita laskennallisesti, että siirtoreaktio ei ole tasapainotilassa. Onko etenevä reaktio tällöin nopeampi kuin palautuva reaktio? 6 p.
Tasapainovakion arvo on 101 lämpötilassa 500 K.
(1 p.)
Tasapainovakion lauseke:
K = \mathrm{\frac{[CO_2][H_2]}{[CO][H_2O]}} = 101
Lausekkeeseen sijoitetaan seoksen konsentraatiot:
Q = \frac{\left[\frac{0{,}95}{5{,}0}\right]\left[\frac{0{,}95}{5{,}0}\right]}{\left[\frac{0{,}019}{5{,}0}\right]\left[\frac{0{,}52}{5{,}0}\right]} = 91.
(2 p.)
- jos ei ole laskettu Q-arvoa, tai sen laskemisessa on periaatevirhe, sekä jos K:n arvo puuttuu ei-VSE selitysosuuteen ja maks. 2 p. tehtävästä
Q < K, joten reaktio ei ole tasapainossa, sillä konsentraatiot eivät vastaa tasapainovakion mukaisia konsentraatioita. (Merkintää Q ei vaadita.)
(1 p.)
Jotta reaktio olisi tasapainossa, osoittajan tulee kasvaa. Tällöin lopputuotteita
tulee muodostua lisää.
(1 p.)
Etenevä reaktio on nopeampi kuin palautuva reaktio.
(1 p.)
8.3 Toisessa koejärjestelyssä tutkittava seos oli lämpötilassa 500 K suljetussa 5,00 litran astiassa, jossa tasapainokonsentraatiot olivat c(CO) = 0,0104 mol/l, c(H₂O) = 0,0550 mol/l, c(CO₂) = 0,240 mol/l, c(H₂) = 0,240 mol/l. Seos lämmitettiin lämpötilaan 700 K ja tasapainon annettiin asettua uudelleen. Laske, mitkä olivat uudet tasapainokonsentraatiot lämpötilassa 700 K. Ilmoita konsentraatiot kolmen merkitsevän numeron tarkkuudella. 6 p.
Tasapainotarkastelu:
| CO(g) + | H₂O(g) | ⇌ | CO₂(g) | + H₂(g) | |
|---|---|---|---|---|---|
| Alussa [mol/l] (500 K) | 0,0104 | 0,0550 | 0,240 | 0,240 | |
| Muutos 500 K → 700 K | +x | +x | –x | –x | |
| Tasapainossa [mol/l] (700 K) | 0,0104 + x | 0,0550 + x | 0,240 – x | 0,240 – x |
(2 p.)
Tasapainovakion arvo lämpötilassa 700 K on luettu oikein aineistosta.
(1 p.)
Tasapainovakion lauseke ja sen ratkaisu ja tasapainokonsentraatiot:
K=\frac{[0{,}240-x]\cdot[0{,}240-x]}{[0{,}0104+x]\cdot[0{,}0550+x]}=9{,}23
- jos K:n lausekkeen ratkaisussa on periaatevirhe, ei-VSE loppulaskuun ja tehtävästä maks. 3 ensimmäistä pistettä.
8,23x2 + 1,083642x − 0,05232044 = 0
x = 0,0375649 (tai x = −0,169235)
(1 p.)
[CO] = 0,0479649 mol/l ≈ 0,0480 mol/l
[H2O] = 0,0925649 mol/l ≈ 0,0926 mol/l
ja [CO2] = [H2] = 0,2024351 mol/l ≈ 0,202 mol/l
(2 p.)
- Jos vastauksen numerotarkkuus poikkeaa kolmesta merkitsevästä numerosta, −1 p.
Osa 3: 20 pisteen tehtävät
9. Beetasalpaajan kemiaa 20 p.
9.1 Reaktiosarjan I kohdassa a) reaktioon käytetään kaliumkarbonaattia, joka muodostaa emäksisen vesiliuoksen. Miten 1-naftoli reagoi tässä emäksisessä vesiliuoksessa ennen epikloorihydriinin lisäystä? Mitä kohdan a) reaktiossa vapautuisi vesiliuokseen, jos kaliumkarbonaattia ei käytettäisi? 3 p.
1-naftoli on fenoli, joka on heikko happo. 1-Naftoli reagoi protoninsiirtoreaktiolla emäksisessä vesiliuoksessa, jolloin muodostuu sen vastinemästä (naftolaatti-ionia).
(2 p.)
Ilman kaliumkarbonaattia reaktiossa vapautuisi vetykloridihappoa (HCl).
(1 p.)
9.2 Reaktiosarjan I kohdassa b) välituote E reagoi amiinin F kanssa. Miksi yhdisteen E reagoiva funktionaalinen ryhmä on poikkeuksellisen reaktiivinen? 2 p.
Yhdisteen E eetteriryhmä on kolmirenkaassa,
(1 p.)
joka on jännittynyt rakenne (sidoskulmat poikkeavat ideaalista). Siksi se on reaktiivinen.
(1 p.)
9.3 Miksi reaktiosarjan II kohdassa c) täytyy käyttää ylimäärä amiinia F? 3 p.
Reaktiossa syntyy myös HBr:a,
(1 p.)
joka reagoi amiinin kanssa.
(1 p.)
Johtopäätös miksi käytetään ylimäärin amiinia, seuraavasta listasta (johtopäätöspiste edellyttää, että HBr:n muodostuminen on tunnistettu):
- Jotta lähtöaine G reagoi loppuun asti
- Osa amiinista kuluu neutralointireaktioon
- Amiinia kuluu HBr:n vapautumisen takia enemmän reaktiossa
(1 p.)
9.4 (R)- ja (S)-propranololi ovat keskenään enantiomeerejä. Reaktiosarjassa II muodostuu päätuotteena (S)-propranololia, jonka stereokemia on esitetty kuvassa . Sen sijaan reaktiosarjassa I muodostuu (S)- ja (R)-propranololia. Miksi reaktiosarja I ei tuota pelkästään (S)-propranololia? Kuinka paljon reaktiosarjan I propranololissa on (S)-propranololia? Perustele vastauksesi. 4 p.
Lähtöaine epikloorihydriini on raseeminen, eli siinä on suhteessa 1:1 molempia enantiomeerejä. / Reaktiosarjassa 1 ei käytetä kiraalista katalyyttiä, joka mahdollistaisi vain toisen enantiomeerin syntymisen.
(2 p.)
Tällöin myös tuote on raseeminen eli reaktiosarjan propranololissa on 50 % (S)-propranololia.
(2 p.)
9.5 Tutustu aineistoon . Selitä sanallisesti tai piirtämällä, miten propranololin vallitsevan muodon rakenne eroaa pH-arvoissa 3 ja 11. Miksi log D on suurempi pH-arvossa 11 kuin pH-arvossa 3? Voit hyödyntää vastauksessasi rakennekaavaa . 8 p.
Yleisesti ottaen yhdisteen vesiliukoisuus on sitä parempi mitä pienempi on yhdisteen log D-arvo.
(2 p.)
Propranololin aminoryhmä voi protonoitua.
(1 p.)
- jos aminoryhmän kykyä protonoitua ei ole tunnistettu, ei-VSE ja tehtävästä yht. 2 ensimmäistä pistettä.
Happamassa pH-arvossa (pH 3) propranololin aminoryhmä on protonoitunut ja sillä on positiivinen varaus.
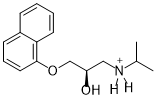 Propranololin protonoitunut muoto
Propranololin protonoitunut muoto
(1 p.)
Emäksisessä liuoksessa (pH 11) propranololin aminoryhmä ei ole protonoitunut.
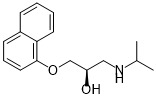 Propranololi, joka ei ole protonoitunut
Propranololi, joka ei ole protonoitunut
(1 p.)
Propranololin aminoryhmän ionisoitunut ja protonoitunut happomuoto on emäsmuotoa poolisempi,
(2 p.)
ja siksi happomuoto edistää propranololin vesiliukoisuutta enemmän kuin emäsmuoto.
(1 p.)
Tämän seurauksena propranololin log D-arvo on matalassa pH-arvossa pienempi ja korkeassa pH-arvossa suurempi.
10. Puskuriliuoksen puskurointikyky 20 p.
10.1 Puskuriliuos valmistetaan typpihapoke- ja natriumnitriittiliuoksista. Minkä pH-arvojen välillä se toimii puskuriliuoksena? Perustele vastauksesi laskuilla. 4 p.
Taulukkokirjasta saadaan typpihapokkeen Kₐ = 7,2 · 10–4 mol/dm³
(1 p.)
K_a=\mathrm{\frac{[H_3O^+][A^-]}{[HA]}}{{,}}\ \mathrm{josta\ [H_3O^+]} = K_a\mathrm{\frac{[HA]}{[A^-]}\ ja\ pH}=-\lg\left(K_a\mathrm{\frac{[HA]}{[A^-]}}\right)
Tässä käytetään merkintöjä HNO₂ = HA ja NO₂⁻ = A⁻.
Suhteen [HA]/[A⁻] tulee olla välillä 0,1–10, jolloin
pHmin = − lg (Kₐ · 10) = 2,14
pHmax = − lg (Kₐ · 0,10) = 4,14
TAI
Käyttäen Hendersonin-Hasselbalchin yhtälöä:
pHmin = pKₐ + lg(0,1) = 3,14 − 1 = 2,14
pHmax = pKₐ + lg(10) = 3,14 + 1 = 4,14
(2 p.)
Vastaus: pH-arvon on oltava välillä 2,14–4,14.
(1 p.)
10.2 Fosforihaposta valmistettua fosfaattipuskuria käytetään usein biologisissa sovelluksissa ylläpitämään oikeaa pH-arvoa, koska kyseisen puskurin raaka-aineet ovat myrkyttömiä soluille ja hinnaltaan edullisia. Solujen sisällä keskimääräinen pH-arvo on noin 7,4. Tässä pH-arvossa fosforihappo esiintyy solun sisällä ioneina \mathrm{H_2PO_4^-} (39 %) ja \mathrm{HPO_4^{2-}} (61 %). Mitä tässä puskuriliuoksessa tapahtuu, kun siihen lisätään happoa tai emästä asteittain yhä enemmän? 6 p.
Reaktioiden kuvaaminen sanallisesti tai reaktioyhtälöillä:
- Hapon (H⁺) lisäys:
Vetyionit reagoivat monovetyfosfaatti-ionin kanssa, (1 p.) jolloin muodostuu divetyfosfaatti-ionia. (1 p.)
TAI
Kirjoitettu reaktioyhtälö:
\mathrm{HPO_4^{2-}(aq)+H^+(aq)\ \rightarrow\ H_2PO_4^-(aq)}
(2 p.)
- Emäksen lisäys:
Emäs/hydroksidi-ioni reagoi divetyfosfaatti-ionin kanssa, (1 p.) jolloin muodostuu monovetyfosfaatti-ionia ja vettä. (1 p.)
TAI
Kirjoitettu reaktioyhtälö:
\mathrm{H_2PO_4^-(aq)+OH^-(aq)\ \rightarrow\ HPO_4^{2-}(aq)+H_2O(l)}
(2 p.)
pH:n muuttumisen kuvaus ja perustelu:
(Neutralointireaktiossa muodostuu heikkoa emästä (\mathrm{HPO_4^{2-}}) tai heikkoa happoa (\mathrm{H_2PO_4^-}), joka protolysoituu vain vähän.)
Alussa pH muuttuu vain vähän.
(1 p.)
Puskurointikyvyn huomioiminen:
Kun lisätään niin paljon emästä tai happoa, että happomuodon ja vastinemäksen välinen suhde [\mathrm{H_2PO_4^-}]:[\mathrm{HPO_4^{2-}}] on suurempi kuin 10 tai pienempi kuin 0,1, liuos ei enää kykene puskuroimaan lisättyä happoa tai emästä. Tällöin pH muuttuu voimakkaasti.
(1 p.)
10.3 pH-mittarien kalibrointiin käytetään usein kahta puskuriliuosta, joiden pH-arvot ovat 4,00 ja 7,00 (t = 25 °C). Miksi pH-mittarin kalibrointiin pH-arvossa 7,00 ei käytetä pelkkää vettä? 3 p.
Vesi ei toimi puskuriliuoksena. / Veden pH ei pysy arvossa 7,00. / Pienetkin epäpuhtaudet muuttavat veden pH-arvoa.
(1 p.)
Puhtaan veden pH riippuu lämpötilasta.
(1 p.)
Varastoitaessa vettä siihen liukenee ilmasta aina jonkin verran hiilidioksidia,
(1 p.)
joka reagoi hiilihapoksi.
(1 p.)
Tällöin liuoksen pH-arvo ei ole tasan 7,00. Puskuriliuos pystyy neutraloimaan hiilidioksidista muodostunutta hiilihappoa.
10.4 Opiskelija valmisti puskuriliuoksen liuottamalla 0,273 g natriumasetaattia veteen ja lisäämällä liuokseen 13,0 ml etikkahappoa, jonka konsentraatio oli 0,250 mol/dm³. Liuoksen kokonaistilavuus oli 100,0 ml. Opiskelija halusi tutkia liuoksen puskurointikapasiteettia. Liuokseen liuotettiin kaliumhydroksidia (KOH) kiinteinä rakeina, yksi rae kerrallaan. Yhden KOH-rakeen massa oli 0,06 g. Kuinka monta kokonaista KOH-raetta liuokseen on vähintään lisättävä, jotta se menettää puskurointikykynsä? Perustele vastauksesi laskuilla. Oletetaan, että kaikkien KOH-rakeiden massa oli sama ja että KOH-rakeiden lisäys ei vaikuttanut liuoksen tilavuuteen. 7 p.
M(CH₃COONa) = 82,034 g/mol
n(CH₃COO⁻, alku) = n(CH₃COONa, alku)
= m(CH₃COONa)/M(CH₃COONa) = 0,273 g/(82,034 g/mol) = 0,00332789 mol
(1 p.)
n(CH₃COOH, alku) = 0,0130 l · 0,250 mol/l = 0,0032500 mol
(1 p.)
Yhdessä KOH-rakeessa on
n(KOH, rae) = m(KOH) / M(KOH) = 0,06 g / (56,108 g/mol) = 0,001069 mol.
Kun lisätään KOH, joka on emäs, se reagoi etikkahapon CH₃COOH kanssa:
OH⁻(aq) + CH₃COOH(aq) → CH₃COO⁻(aq) + H₂O(l).
Tällöin happomuodon ainemäärä vähenee ja emäsmuodon ainemäärä kasvaa:
(1 p.)
- Jos tätä periaatetta ei ole otettu laskussa huomioon, ei-VSE (tehtävästä tällöin yht. 2 ensimmäistä pistettä)
n(CH₃COOH, uusi) = n(CH₃COOH, alku) – x · n(KOH, rae)
n(CH₃COO⁻, uusi) = n(CH₃COO⁻, alku) + x · n(KOH, rae).
(1 p.)
Asetaatti-ionien konsentraation tulee olla yli kymmenkertainen happomuodon konsentraatioon nähden. Koska tilavuus on vakio, KOH-rakeiden lukumäärä voidaan laskea ainemäärien avulla:
n(CH₃COO⁻, uusi) > 10 · (n(CH₃COOH, uusi)).
(1 p.)
Sijoitetaan ainemäärien lausekkeet epäyhtälöön, jossa x on lisättyjen rakeiden määrä:
n(CH₃COO⁻, alku) + x · n(KOH, rae) > 10 · (n(CH₃COOH, alku) − x · n(KOH, rae))
x · n(KOH, rae) + 10 x · n(KOH, rae) > 10 · n(CH₃COOH, alku) − n(CH₃COO⁻, alku)
x > (10 · n(CH₃COOH, alku) − n(CH₃COO⁻, alku)) / (11 · n(KOH, rae))
x > (10 · 0,0032500 mol − 0,00332789 mol) / (11 · 0,001069 mol)
x > 2,48
(1 p.)
Vastaus: Liuokseen on lisättävä vähintään kolme kokonaista KOH-raetta, jotta se menettää puskurointikykynsä. (1 p.)
11. Proteiinit ja peptidit 20 p.
11.1 Oksitosiini on pieni peptidihormoni, joka koostuu yhdeksästä aminohaposta. Sitä voidaan käyttää synnytyksen käynnistämiseen. Tarkastele aineistossa esitettyä rakennetta ja esitä oksitosiinissa välillä Cys1 ja Cys6 olevien aminohappojen järjestys alkaen kysteiinistä Cys1. Käytä aminohapoista kolmikirjaimisia lyhenteitä. 6 p.
Ketju on Cys-Tyr-Ile-Gln-Asn-Cys.
(1 p. / oikea aminohappo, 2 p. oikea järjestys edellyttäen, että kaikki neljä aminohappoa on oikein)
- Jos vastauksessa on annettu ylimääräisiä aminohappoja, −1 p./aminohappo ja tällöin järjestyspisteitä ei ansaita.
11.2 Mikä on kuvaan katkoviivalla merkitty vuorovaikutus? Miten aminohapot Cys1 ja Cys6 ovat sitoutuneet toisiinsa? Miten katkoviivalla merkitty vuorovaikutus ja Cys1- ja Cys6-aminohappojen välinen sidos vaikuttavat oksitosiinin laskostumiseen? 5 p.
Kyseessä on vetysidos. Se stabiloi esitettyä konformaatiota.
Keltainen rakenne on rikkisilta / disulfidisidos / kahden rikkiatomin välinen kovalenttinen sidos. Rikkisilta on kahden kysteiinin välillä. Rikkisilta lukitsee molekyylin renkaaksi.
Pisteitys:
- sidosten tunnistaminen: 1 oikein 2 p., molemmat oikein 3 p.
- Vaikutus avaruusrakenteeseen 2 p. (vaikutuspiste edellyttää, että sidos on tunnistettu),
1 p. / vaikutus:
- Vetysidos/rikkisilta lujittaa / vakauttaa kolmiulotteisen rakenteen / kolmiulotteisen muodon / avaruusrakenteen.
- Vetysidos/rikkisilta säilyttää/vakauttaa reseptoriin / toiminnalle/aktiivisuudelle tarvittavan muodon.
- Vetysidos/rikkisilta lukitsee / jäykistää /vakauttaa/tmv. ilmaisu molekyylin / rakenteen / laskoksen.
- Rikkisilta lukitsee molekyylin renkaaksi.
11.3 Kuvassa on esitetty insuliinin rakenne. Kuvaan on merkitty myös proteiinin sekundäärirakennetta punaisella leveällä ja harmaalla kapealla nauhalla. Minkä niminen on kuvassa punaisella leveällä nauhalla esitetty sekundäärirakenne? Mitä muita sekundäärirakenneosia proteiineissa yleisesti esiintyy? 3 p.
Sekundäärirakenteita ovat α-kierteet ja β-laskokset sekä β-käänteet. Punaisella leveällä nauhalla esitetty sekundäärirakenne on α-kierre.
Pisteitys:
- α-kierre tunnistettu ja kohdistettu oikein, 2 p.
- lisäksi löytyy β-laskos, 1 p.
11.4
Kollageeni on tärkeä sidekudosproteiini, jonka muodostumiseen tarvitaan proteiinin yhden aminohapon muokkaus hapettamalla. Hapettumista katalysoi entsyymi, joka tarvitsee toimiakseen C-vitamiinia. Pitkään jatkuva C-vitamiinin puute johtaa keripukkiin, jossa ihmisen sidekudokset vaurioituvat, ikenet vetäytyvät ja iho alkaa vuotaa verta.
Aineistossa on esitetty pallotikkumallilla osa kollageenin aminohappoketjusta. Kollageeni koostuu proliinista, glysiinistä ja kolmannesta aminohaposta, joka ei kuulu 20 tavallisen luonnon aminohapon joukkoon. Juuri tämä aminohappo syntyy proteiiniin entsymaattisen hapetusreaktion avulla. Esitä tämän kolmannen aminohapon rakennekaava. Piirrä rakennekaava siten, että siitä ilmenee myös aminohapon asymmetristen hiilten stereokemia eli sidosten avaruudellinen suuntautuminen.
6 p.
Kolmas aminohappo on
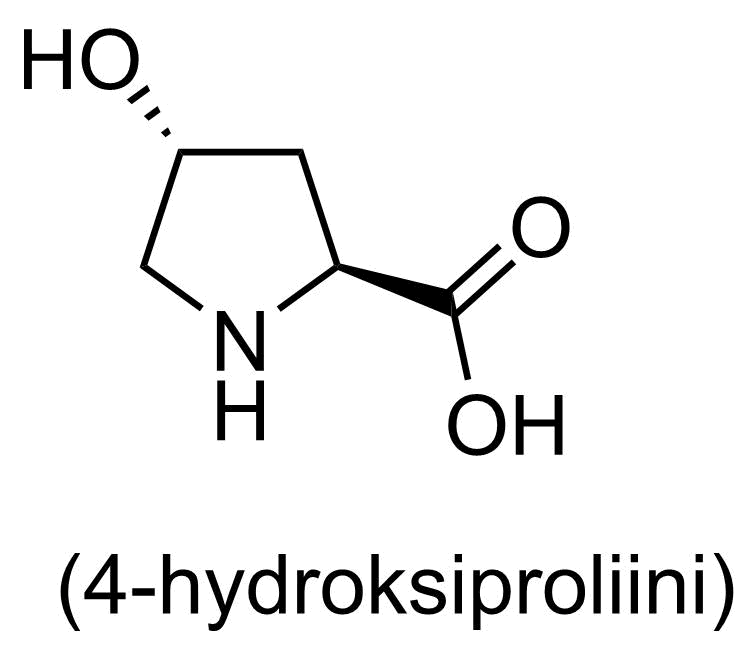 4-hydroksiproliinin rakenne
4-hydroksiproliinin rakenne
Pisteitys:
- funktionaaliset ryhmät oikein 3 p.
- oikea paikkaisomeeri 1 p. (edellyttäen, että kaikki edelliset pisteet on ansaittu)
- esitetty trans-isomeeri 1 p. (edellyttäen, että kaikki edelliset pisteet on ansaittu)
- esitetty oikea enantiomeeri 1 p. (edellyttäen, että kaikki edelliset pisteet on ansaittu)