Beskrivningar av goda svar: SV – Kemi
25.3.2022
Slutgiltiga beskrivningar av goda svar 17.5.2022
Grunderna enligt vilka bedömningen gjorts framkommer i de slutgiltiga beskrivningarna av goda svar. Uppgiften om hur bedömningsgrunderna tillämpats på examinandens provprestation utgörs av de poäng som examinanden fått för sin provprestation, de slutgiltiga beskrivningarna av goda svar och de föreskrifter gällande bedömningen som nämnden gett i sina föreskrifter och anvisningar. De slutgiltiga beskrivningarna av goda svar innehåller och beskriver inte nödvändigtvis alla godkända svarsalternativ eller alla godkända detaljer i ett godkänt svar. Eventuella bedömningsmarkeringar i provprestationerna anses vara jämställbara med anteckningar och sålunda ger de, eller avsaknaden av markeringar, inte direkta uppgifter om hur bedömningsgrunderna tillämpats på provprestationen.
Med studentexamensprovet utreds om studerandena tillägnat sig de kunskaper och färdigheter som anges i gymnasiets läroplan och uppnått tillräcklig mognad enligt målen för gymnasieutbildningen. Målet för bedömningen i läroämnet kemi är en förståelse för och en tillämpning av den kemiska kunskapen. Vid bedömningen beaktas även de färdigheter med vilka man tillägnar sig experimentell kunskap och förmågan att behandla den. Till sådan kunskap hör till exempel planering av experiment, trygg hantering av arbetsredskap och reagens, presentation och tolkning av resultat samt förmågan att dra slutsatser och tillämpa dem.
Vid bedömningen av uppgifterna i kemi läggs vikten vid ett framställningssätt som betonar läroämnets karaktär och vid precision i begreppen och språkbruket. Reaktionsformlerna ställs upp utan oxidationstal med minsta möjliga heltalskoefficienter och med aggregationstillstånden angivna. I organiska reaktionslikheter används strukturformler, men aggregationstillstånd krävs inte. Olika sätt att skriva strukturformler godkänns.
I beräkningsuppgifter ska storhetsekvationer och formler användas på ett sätt som visar att examinanden förstått uppgiften rätt och tillämpat korrekt princip eller lag i sin lösning. Av svaret framgår entydigt hur man når slutresultatet, men omfattande mellansteg behövs inte. CAS-program kan utnyttjas i uppgiftens olika skeden. De principer och lagar som gäller den aktuella situationen samt uppgiftens slutresultat och de slutsatser som dras utgående från lösningen är av central betydelse och ska framgå av svaret. Slutresultaten ges med enheter och med den noggrannhet som utgångsvärdena kräver, och slutsatserna motiveras.
Mätresultat och grafer som ritats utgående från dessa utnyttjas vid analysen av data och då man drar slutsatser. Till mätpunkterna anpassas en vederbörlig rät linje eller en böjd kurva, till exempel med hjälp av någon anpassningsfunktion. Om mätpunkterna ligger nära varandra behöver en egentlig anpassningsfunktion inte införas. Värden som ligger mellan mätpunkterna kan interpoleras med ögonmått genom visuell avläsning av grafen eller med hjälp av ett lämpligt program. Axlarnas namn, enheter och skala märks ut i grafen. I grafen anges sådana punkter som är väsentliga för slutsatserna, som ekvivalenspunkten för en titrerkurva eller tangenten som används när man beräknar en hastighet vid en given tidpunkt.
I essäsvar och förklarande svar kompletteras texten med reaktionsformler, ekvationer eller teckningar. Fenomenen som behandlas beskrivs på makroskopisk, mikroskopisk och symbolisk nivå. Av svaret framgår att det material som hör ihop med uppgiften har använts, tillämpats, analyserats och utvärderats i enlighet med uppgiftsformuleringen. Ett svar på god nivå är välstrukturerat och innehållsmässigt konsekvent.
Svaren bedöms enligt de kriterier som gäller för respektive uppgift. Utgångspunkten vid bedömningen är de förtjänster för vilka poäng ansamlas. Om en central kemisk princip saknas eller är felaktig avslutas poängansamlingen. Då godkänns inte fortplantning av det felaktiga resultatet (ej-FF). För övriga brister eller fel godkänns fortplantning av det felaktiga resultatet (FF), och då fortsätter ansamlingen av poäng efter bristfälligheten eller felet. I de krävande uppgifterna mot slutet av provet förutsätts en större precision i behandlingen av principer än i de grundläggande uppgifterna i början av provet. Ur kemisk synvinkel inexakt språkbruk, små räknefel eller slarvig användning av närmevärden orsakar avdrag på 0–3 p.
Del 1: 20-poängsuppgift
1. Flervalsuppgifter från kemins olika delområden 20 p.
1.1 En NaCl(aq)-lösning är 2 p.
- en homogen blandning. (2 p.)
1.2 I vilken förening har bindningarna mest jonkaraktär? 2 p.
- KH (2 p.)
1.3 Vilken av följande bindningar är en vätebindning? 2 p.
- Bindningen mellan NH₃-molekyler (2 p.)
1.4 Ett av rheniums kloridsalter innehåller 63,6 massprocent rhenium. Vilken är proportionsformeln (den empiriska formeln) för detta salt? 2 p.
- ReCl₃ (2 p.)
1.5
I ett elektrokemiskt element består den ena elektroden av en Ag-skiva i en Ag+(aq)-lösning och den andra elektroden av en Pt-skiva i en S2O82–(aq)-lösning. Reduktionspotentialerna är
\begin{align}
\mathrm{Ag^+\left(aq\right)\ +\ e^-\ \rightarrow\ Ag\left(s\right)} && E^{\circ}\ =\ 0{,}80\ \mathrm{V} \\
\mathrm{S_2O_8^{2-}\left(aq\right)\ +\ 2e^-\ \rightarrow\ 2\ SO_4^{2-}\left(aq\right)} && E^{\circ}\ =\ 2{,}01\ \mathrm{V}
\end{align}
Vilken är källspänningen för elementet som bildats?
2 p.
- 1,21 V (2 p.)
1.6 En vattenlösning innehåller Au+-, Co2+-, Mg2+- och Sn2+-joner, var och en med koncentrationen 1,0 mol/dm3. Lösningen elektrolyseras så att spänningen ökas lite i taget. I vilken ordning kommer metallerna att falla ut på katoden? 2 p.
- Au, Sn, Co; däremot faller Mg inte ut (2 p.)
1.7 Hur kan man bestämma den tredimensionella strukturen hos ett okänt protein? 2 p.
- med röntgenkristallografi (2 p.)
1.8 Ordna följande redskap som används för att mäta upp vätskor från det mest noggranna till det minst noggranna då man ska mäta upp en volym på 25,0 ml: dekanterglas, mätpipett, mätglas, fyllpipett. 2 p.
- fyllpipett, mätpipett, mätglas, dekanterglas (2 p.)
1.9 Grafen nedan visar koncentrationerna c för de ämnen som deltar i en katalyserad reaktion som funktion av tiden t. Vilken av kurvorna visar den fria (som inte är bunden till substratet eller till produkten) katalysatorns koncentration? 2 p.
- B (2 p.)
1.10 Hur mycket värme binds eller frigörs i följande reaktion utgående från bildningsvärmena för ämnena som deltar i reaktionen, då en mol Fe₂O₃(s) reagerar? 2 p.
- Det frigörs 26,8 kJ värme. (2 p.)
Del 2: 15-poängsuppgifter
2. Framställning av svavelsyra 15 p.
2.1 Skriv totalreaktionens reaktionsformel (reaktionslikhet). 5 p.
Totalreaktionen erhålls genom att addera de reaktioner som följer på varandra
Poängsättning:
- totalreaktionen är fel men i början har man multiplicerat reaktionsformlerna med rätt tal, 0–2 p.
- rätt totalreaktion, 5 p.
- om något ämne inte har förkortats från totalreaktionen, −1 p./ämne
4FeS₂(s) + 11O₂(g) → 2Fe₂O₃(s) + 8SO₂(g)
2SO₂(g) + O₂(g) → 2SO₃(g) │· 4
SO₃(g) + H₂SO₄(aq) → H₂S₂O₇(aq) │· 8
H₂S₂O₇(aq) + H₂O(l) → 2H₂SO₄(aq) │· 8
Då får vi:
4FeS₂(s) + 11O₂(g) → 2Fe₂O₃(s) + 8SO₂(g)
8SO₂(g) + 4O₂(g) → 8SO₃(g)
8SO₃(g) + 8H₂SO₄(aq) → 8H₂S₂O₇(aq)
8H₂S₂O₇(aq) + 8H₂O(l) → 16H₂SO₄(aq)
Totalreaktionen:
4FeS₂(s) + 15O₂(g) + 8H₂O(l)→ 2Fe₂O₃(s) + 8H₂SO₄(aq)
2.2 Hur många kilogram svavelsyra bildas då man har 3 755 kg pyrit, FeS₂, till sitt förfogande och man antar att det bildas svavelsyra vars halt är 100 massprocent? Hur många kilogram svavelsyra med halten 95 massprocent kan man framställa av den här mängden svavelsyra? 7 p.
n(FeS₂) = m / M = 3 755 000 g / (119,99 g/mol) = 31 294,2745 mol
(2 p.)
n(H₂SO₄) = 2 · n(FeS₂) = 62 588,549 mol
(2 p.)
m(H₂SO₄)100 % = n · M = 62 588,549 mol · 98,086 g/mol = 6 139 060 g ≈ 6 139 kg
(1 p.)
m(H₂SO₄)95 % = m(H₂SO₄)100 % / 0,95 = 6 139 060 g / 0,95 = 6 462 169 g ≈ 6 462 kg
(2 p.)
2.3 I ett laboratorium framställer man en utspädd lösning vars koncentration är 1,00 mol/l utgående från svavelsyra med halten 95 massprocent. Vilka arbetssäkerhetsfaktorer måste man beakta i det arbetet? Motivera ditt svar. 3 p.
Svavelsyra är en frätande vätska. (1 p.)
Då man hanterar den måste man använda skyddsglasögon, skyddshandskar och labbrock. (1 p.)
Det är tryggast att framställa en lösning i dragskåp.
ELLER
Då man späder ut syran sätter man först lite vatten på botten av mätflaskan för att undvika stänk, och först sedan pipetteras svavelsyran. (1 p.)
3. Okänt kemikalieavfall 15 p.
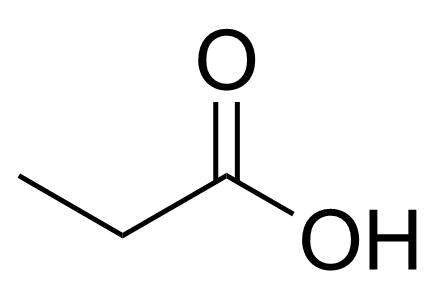
3.1 Föreningen C₃H₆O₂ har en strukturisomer som kan ge upphov till en tydligt sur vattenlösning. Rita strukturformeln för denna strukturisomer. 2 p.
3.2 Rita alla föreningens C₃H₆O₂ strukturisomerer som innehåller en estergrupp. 4 p.
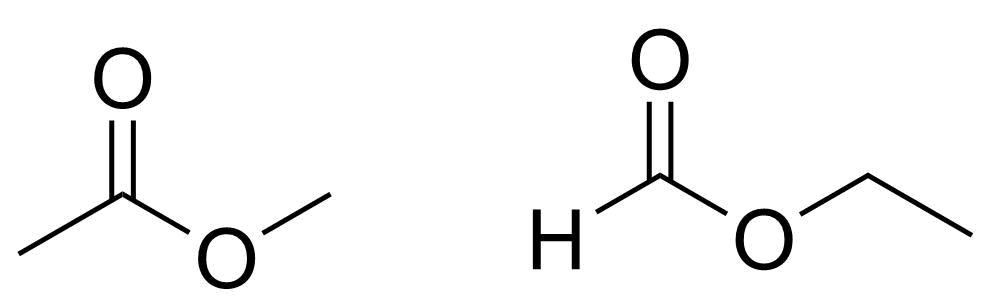 Strukturerna för metyletanat H₃CCOOCH₃ och etylmetanat HCOOC₂H₅
Strukturerna för metyletanat H₃CCOOCH₃ och etylmetanat HCOOC₂H₅
2 p./struktur
- överlopps felaktig struktur, −2 p./struktur
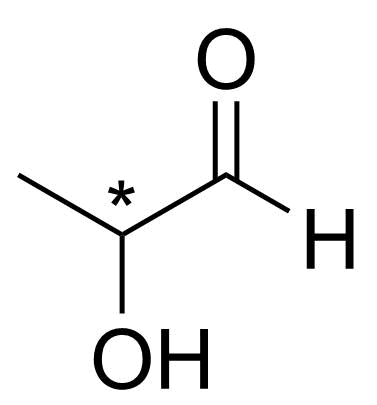
3.3 Rita alla föreningens C₃H₆O₂ strukturisomerer som kan oxideras så att det bildas en aldehydgrupp i molekylen. 4 p.
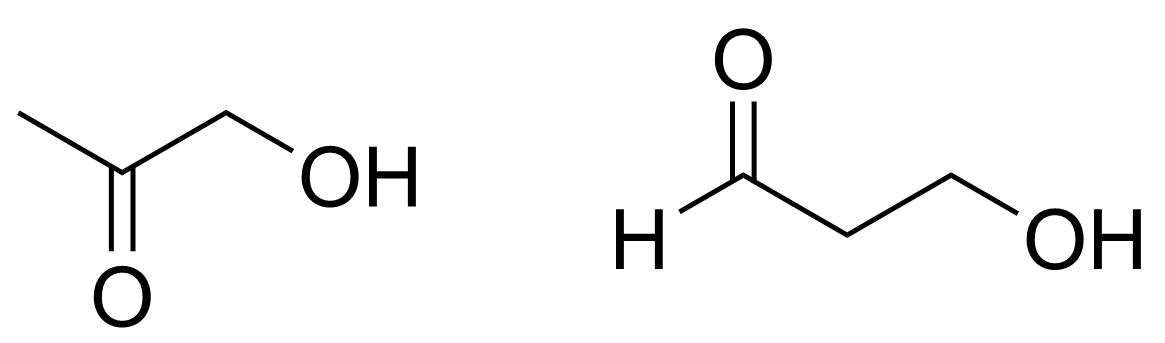 Strukturerna för 1-hydroxipropan-2-on H₃CCOCH₂OH och 3-hydroxipropanal OHCCH₂CH₂OH
Strukturerna för 1-hydroxipropan-2-on H₃CCOCH₂OH och 3-hydroxipropanal OHCCH₂CH₂OH
2 p./struktur
- överlopps felaktig struktur, −2 p./struktur
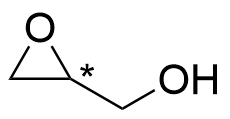
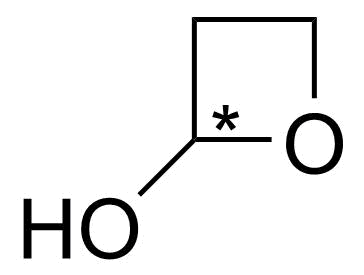
3.4 Rita upp en strukturisomer till föreningen C₃H₆O₂ som har ett asymmetricentrum. Märk ut asymmetricentrumet i strukturformeln till exempel med en stjärna. 3 p.
eller
eller
Bilder: Möjliga isomerer som har ett asymmetriskt centrum (den nedersta strukturen är instabil).
Strukturen 2 p., asymmetricentret har märkts ut rätt 1 p.
3.5 Vilka anteckningar borde forskaren ha gjort på kemikalieavfallsflaskan? 2 p.
Avfallsflaskan ska förses med beteckningen ”avfall”. Avfallets sammansättning ska beskrivas. (1 p.) Faropiktogrammen för avfallskemikalien i flaskan ska fästas på flaskan. (1 p.)
(Avfallsflaskan ska också förses med anteckning om namnet på personen som producerat avfallet samt datum.)
4. Materialeffektiviteten och miljöbelastningen för en syntes 15 p.
4.1 I material beskrivs syntesen av butylacetat. Beräkna det procentuella utbytet av butylacetat. 4 p.
Vi beräknar den begränsande faktorn i reaktionen:
n(CH₃(CH₂)₃OH) = m / M = 37,0 g / (74,12 g/mol) = 0,49919 mol
n(CH₃CO₂H) = m / M = 60,0 g / (60,052 g/mol) = 0,99913 mol
(1 p.)
Butan-1-ol och ättiksyra reagerar i molförhållandet 1:1.
→ Butan-1-ol är den begränsande faktorn i reaktionen.
(1 p.)
nteor(butylacetat) = n(CH₃(CH₂)₃OH) = 0,49919 mol
mteor(butylacetat) = nteor(butylacetat) · M(butylacetat)
= 0,49919 mol · 116,156 g/mol = 57,984 g
(1 p.)
utbytes-% = (verkligt utbyte) / (teoretiskt utbyte) = 40,0 g / (57,984 g) = 0,6898, så utbytes-% var 69,0 %.
(1 p.)
4.2 Beräkna atomekonomin (AE, %) för syntesen av butylacetat med hjälp av material och . Ge svaret med tre gällande siffrors noggrannhet. 3 p.
AE, % = ν(produkt) · M(produkt) / (Σνi · Mi)
AE, % = (116,56 g/mol) / (74,12 g/mol + 60,052 g/mol) = (116,156 g/mol) / (134,172 g/mol)
(2 p.)
= 0,8657, alltså 86,6 %
(1 p.)
4.3 Beräkna miljöfaktorn (E-faktorn) för syntesen av butylacetat med hjälp av material och . 3 p.
E-faktor = (summan av massorna för det avfall och de biprodukter som bildas i syntesen) / (den renade slutproduktens massa)
E-faktor = (250 g + 125 g + 25,0 g + 5,0 g + 37,0 + 60,0 − 40,0 g) / (40,0 g) = (462 g) / (40,0 g) = 11,55 ≈ 11,6
Poängsättning: nämnaren rätt, 1 p.; täljaren rätt 1 p.; svaret rätt 1 p.
4.4
Vilka är värdena för det procentuella utbytet, atomekonomin och miljöfaktorn i en fullständigt ideal kemisk syntes?
Utvärdera materialeffektiviteten och miljöbelastningen för syntesen av butylacetat som beskrivs i material utgående från resultaten i uppgifterna 4.1–4.3 och syntesens reaktionsformel.
5 p.
Värdena i en fullständigt ideal kemisk syntes (1 p. då alla tre värden är rätt):
utbytes-% = 100
AE, % = 100
E-faktor = 0
Materialeffektiviteten och miljöbelastningen för butylacetatets syntesreaktion (högst 4 p. ur poängkorgen nedan; 1 p./motivering)
Analys av utbytet
- Observerat att det är fråga om en jämviktsreaktion och att det procentuella utbytet (69,0 %) mot den bakgrunden är skäligt.
- Om man tillämpade reaktionen industriellt skulle en förlust på 31,0 % av produkterna innebära att en stor mängd utgångsämnen eller produkter går till spillo.
Analys av atomekonomins värde
- Den enda biprodukten som bildas är vatten som är ett småmolekylärt ämne. Vattnet har koefficienten 1 i syntesreaktionen. Därmed är biproduktens andel liten och atomekonomin är god/närapå så hög den kan vara.
Analys av miljöfaktorns värde
- Avfall bildas främst då reaktionsprodukten separeras och rengörs (vatten och tvättlösningar).
- Även om det bildas ganska mycket avfall utgör vattenlösningar den största delen av avfallet.
Allmänna observationer om hur trygga ämnena i reaktionsformeln är samt om syntesens energiförbrukning
- Då man bedömer miljöbelastningen borde man också beakta energiförbrukningen samt sättet på vilket energin produceras. Detta beaktas inte i de beräknade storheterna.
5. Fysiologisk saltlösning 15 p.
5.1
Rita upp standardlinjens graf utgående från mätresultaten i tabell och bestäm linjens ekvation.
En fysiologisk saltlösning som används för att intravenöst tillföra vätska till en människa innehåller 4,50 gram natriumklorid i totalvolymen 500,0 ml. Vilken är den elektriska ledningsförmågan hos en fysiologisk saltlösning?
7 p.
Skärmdump från GeoGebra:
(2 p.)
Standardlinjens ekvation är
κ = (102,5 (mS · dm³)/(cm · mol)) · c(NaCl) – 0,2500 mS/cm.
(1 p.)
Enheter behöver inte anges i svaret. Anpassning av linjen till origo innebär ett litet principfel som inte leder till poängavdrag.
n(NaCl) = m / M = 4,50 g / 58,44 g/mol = 0,077002 mol
(1 p.)
c(NaCl) = n / V = 0,077002 mol / 0,5000 dm³ = 0,15400 mol/dm³
(1 p.)
Koncentrationsvärdet har satts in i linjens ekvation eller den elektriska ledningsförmågan har avlästs från grafen (avläsningssättet ska framgå, t.ex. som en insatt punkt eller ett streck i bilden):
κ = (102,5 (mS · dm³)/(cm · mol)) · c(NaCl) – 0,2500 mS/cm
(1 p.)
= 102,5 (mS · dm³)/(cm · mol) · 0,15400 mol/dm³ – 0,2500 mS/cm
= 15,535 mS/cm ≈ 15,5 mS/cm
(1 p.)
5.2 Vad händer om man använder en lösning som är mer utspädd eller mer koncentrerad än en fysiologisk saltlösning för intravenös vätskebehandling? 4 p.
Osmos betyder att vattnet/lösningsmedlet överförs från en mer utspädd lösning till en mer koncentrerad lösning så att skillnaderna i halten jämnas ut.
(2 p.)
Om man vid intravenös vätskebehandling använde en saltlösning som är mer utspädd än en fysiologisk saltlösning skulle vatten överföras från blodets plasma till cellerna.
(1 p.)
Den här osmotiska vattenströmningen skulle kunna leda till att celler töjs ut och till och med bryts sönder. Till exempel innebär hemolys att röda blodkroppar sönderfaller.
(1 p.; då förutsätts att den föregående poängen har erhållits)
Om man vid intravenös vätskebehandling använde en saltlösning som är mer koncentrerad än en fysiologisk saltlösning skulle vatten överföras från cellerna till blodets plasma.
(1 p.)
Då skulle till exempel de röda blodkropparna krympa.
(1 p.; då förutsätts att den föregående poängen har erhållits)
5.3 Man använder ofta en natriumkloridlösning som standardlösning för kalibrering av konduktometrar. För det här ändamålet framställde man i en 25 ml mätkolv en standardlösning vars elektriska ledningsförmåga var 20,0 mS/cm. Arbetet inleddes med att först tillverka en stamlösning av NaCl vars koncentration var 2,00 mol/l i en 100 ml mätkolv. Hur stor volym av stamlösningen måste man pipettera i 25 ml mätkolven? 4 p.
cstd-lösning = (κ + 0,2500 mS/cm) / (102,5 (mS · dm³)/(cm · mol))
= (20,0 mS/cm + 0,2500 mS/cm) / (102,5 (mS · dm³)/(cm · mol)) = 0,197561 mol/l
(1 p.)
cstd-lösning · Vstd-lösning = cstamlösning · Vstamlösning
Vstamlösning = cstd-lösning · Vstd-lösning / cstamlösning
= 0,197561 mol/ dm³ · 0,025 dm³ / (2,00 mol/ dm³)
(2 p.)
= 2,469512 · 10–3 dm³
≈ 2,47 ml
(1 p.)
6. Att utnyttja luktsinnet vid titreringar 15 p.
6.1 Bestäm pH-värdet vid den här titreringens ekvivalenspunkt. Motivera ditt svar. 2 p.
Titreringens ekvivalenspunkt är vid pH-värdet 7, (1 p.) för det är fråga om en reaktion mellan en stark bas och en stark syra. (1 p.)
6.2 Vilket var pH-värdet för propplösarlösningen? 6 p.
I titreringen sker reaktionen:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
n(HCl) = c(HCl) · V(HCl) = 0,200 mol/l · 0,0177 l = 0,00354 mol
(1 p.)
Enligt reaktionsformeln gäller n(NaOH) = n(HCl)
(1 p.)
c(NaOH) = n(NaOH) / V(NaOH) = 0,00354 mol / 0,0100 l = 0,354 mol/l
(1 p.)
- division med volymen 17,7 ml, alltså ekvivalenspunktens totalvolym, ej-FF till pH-beräkningen och max de 2 första poängen för uppgiften.
[OH⁻] = c(NaOH) = 0,354 mol/l
pOH = −lg[OH⁻] = −lg[0,354 mol/l] = 0,451
(1 p.)
pH = 14,00 – 0,451 = 13,549 ≈ 13,55
(2 p.)
6.3 Vilka är förutsättningarna för att man ska kunna utnyttja en förändring i lukten vid en titrering? Diskutera saken med tanke på observationen av ekvivalenspunkten och på hur titreringen utförs i praktiken. 4 p.
Faktorer som inverkar på observation av ekvivalenspunkten och på hur titreringen utförs i praktiken, sammanlagt högst 4 p.:
- Indikatorn reagerar vid titreringens ekvivalenspunkt.
Eller
- Lukten kan tydligt urskiljas direkt vid titreringens ekvivalenspunkt.
Eller
- Reaktionen som orsakar lukten börjar inte före ekvivalenspunkten.
(2 p.) - Inget av ämnena som deltar i titreringen får vara skadligt för hälsan om det inandas./ Indikatorgasen är inte giftig eller skadlig. (2 p.)
Övriga vettiga förklaringar, max 1 p., till exempel
- Man kan förnimma lukten under en tid på minst några sekunder.
- Lukten bedövar inte luktsinnet.
- Lukten som indikatorn ger upphov till är inte för stark eller obehaglig.
- Titreringsmetoden kan reproduceras.
6.4 Lukten som observeras vid ekvivalenspunkten orsakas av disulfid och tiosulfonat. De här föreningarna bildas i reaktionerna som beskrivs i material . Vilken roll har allinas i reaktion A? Vilka typer av reaktioner är reaktionerna B och C? 3 p.
Allinas är ett enzym/en katalysator som försnabbar reaktionen. (1 p.)
B: kondensationsreaktion (1 p.)
C: oxidations-reduktionsreaktion (1 p.)
7. Xenons föreningar 15 p.
7.1 Xenondifluorid i fast form reagerar långsamt med vatten. I reaktionen bildas xenon, syre och vätefluorid. Skriv reaktionsformeln (reaktionslikheten) som beskriver den här reaktionen. Hur förändras atomernas oxidationstal i reaktionen? 5 p.
2XeF2(s) + 2H2O(l) → 2Xe(g) + 4HF(aq) + O2(g)
(3 p.)
- rätt ämnen 1 p.
- rätt koefficienter 1 p. (då förutsätts att ämnena är rätt)
- rätt aggregationstillstånd 1 p. (då förutsätts att ämnena är rätt)
| Grundämne | I början | I slutet |
|---|---|---|
| Xe | +2 | 0 |
| F | –1 | –1 |
| H | +1 | +1 |
| O | –2 | 0 |
(2 p.)
- förändringen i oxidationstillståndet för syre 1 p.
- förändringen i oxidationstillståndet för xenon 1 p.
- om oxidationstillståndet för väte eller fluor förändras, −1 p./ämne
7.2 Xenon bildar xenonsyra H₂XeO₄ vars salter kallas xenater. Natriumvätexenat NaHXeO₄ i fast form reagerar med en vattenlösning av natriumhydroxid, och då bildas vattenlöslig natriumperxenat Na₄XeO₆ och xenongas. I reaktionen bildas också syre och vatten. Skriv reaktionsformeln som beskriver den här reaktionen. Hur förändras atomernas oxidationstal i reaktionen? 6 p.
2NaHXeO4(s) + 2NaOH(aq) → Na4XeO6(aq) + Xe(g) + O2(g) + 2H2O(l)
(3 p.)
- rätt ämnen 1 p.
- rätt koefficienter 1 p. (då förutsätts att ämnena är rätt)
- rätt aggregationstillstånd 1 p. (då förutsätts att ämnena är rätt)
| Grundämne | I början | I slutet |
|---|---|---|
| Na | +1 | +1 |
| H | +1 | +1 |
| Xe | +6 | +8 och 0 |
| O | –2 | –2 och 0 |
(3 p.)
- förändringen i oxidationstillståndet för syre 1 p.
- förändringen i oxidationstillståndet för xenon 1 p. +1 p.
- om oxidationstillståndet för väte eller fluor förändras, −1 p./ämne
Svaret 6NaHXeO4(s) + 2NaOH(aq) → 2Na4XeO6(aq) + 4Xe(g) + 5O2(g) + 4H2O(l) godkänns också.
7.3 Helium och neon bildar inte stabila föreningar. Xenon å sin sida bildar ett flertal stabila föreningar i vilka xenon förekommer som katjon. Varför bildar xenon katjoner lättare än helium och neon? 4 p.
Bildandet av en katjon:
Ur svaret framgår att en elektron avges: Då katjonen bildas är det fråga om jonisering. / Katjonen bildas då atomen oxideras / avger en (ytter)elektron/elektroner. / En katjon är en jon som har en positiv laddning.
(1 p.)
Motiveringsdelen:
Jonisationsenergin blir mindre då man går nedåt i en grupp. / Xenons jonisationsenergi är mindre än heliums och neons.
Den mindre jonisationsenergin beror på att ytterelektronerna i xenon är längre från kärnan / det finns färre elektronskal mellan kärnan och det yttersta skalet.
(2 p.)
ELLER:
Xenon har flera elektronskal. / Ytterelektronerna i xenon är längre från kärnan.
Då är dragningskraften mellan (den positiva) kärnan och elektronerna svagare. / Då är de repulsiva krafterna större mellan elektronerna.
(2 p.)
Slutsats:
Därför binds ytterelektronerna svagare / lossnar ytterelektronerna lättare i xenon än i helium eller neon.
(1 p.; då förutsätts att något föregående poäng har erhållits)
8. Vattengasens konverteringsreaktion 15 p.
8.1 Motivera med hjälp av material om konverteringsreaktionen är exoterm eller endoterm. 3 p.
Tolkning av grafen och tabellen:
Reaktionens jämviktskonstant K blir större då temperaturen sjunker.
(1 p.)
Svaret har motiverats med att jämviktstillståndet förskjuts mot den endotermiska riktningen då temperaturen stiger, eller med att jämviktstillståndet förskjuts mot den exotermiska riktningen då temperaturen sjunker.
ELLER
Ur svaret framgår att nämnaren i jämviktskonstantens uttryck blir större och/eller att täljaren blir mindre.
ELLER
I svaret förklaras förskjutningen av jämviktstillståndet med hjälp av Le Chateliers princip.
(1 p.)
Reaktionen är exoterm.
(1 p.; då förutsätts att något föregående poäng har erhållits)
8.2 Man studerar en blandning som är innesluten i ett slutet kärl på 5,00 liter och som innehåller 0,019 mol kolmonoxid, 0,52 mol vatten, 0,95 mol koldioxid och 0,95 mol väte vid temperaturen 500 K. Visa genom att beräkna att konverteringsreaktionen inte är i sitt jämviktstillstånd. Är den framåtskridande reaktionen (reaktionen till höger) då snabbare än den bakåtskridande reaktionen (reaktionen till vänster)? 6 p.
Värdet för jämviktskonstanten är 101 vid temperaturen 500 K.
(1 p.)
Jämviktskonstantens uttryck:
K = \mathrm{\frac{[CO_2][H_2]}{[CO][H_2O]}} = 101
Blandningens koncentrationer har satts in i uttrycket:
Q = \frac{\left[\frac{0{,}95}{5{,}0}\right]\left[\frac{0{,}95}{5{,}0}\right]}{\left[\frac{0{,}019}{5{,}0}\right]\left[\frac{0{,}52}{5{,}0}\right]} = 91.
(2 p.)
- Om inte Q-värdet har beräknats eller om det förekommer något principfel i uträkningen av Q samt om värdet för K saknas, ej-FF till förklaringsdelen av svaret och max 2 p. för uppgiften.
Q < K, så reaktionen är inte i jämvikt eftersom koncentrationerna inte uppfyller jämviktskonstanten. (Beteckningen Q krävs ej.)
(1 p.)
För att reaktionen ska vara i jämvikt måste täljaren bli större. Då måste det bildas mera produkter.
(1 p.)
Den framåtskridande reaktionen är snabbare än den bakåtskridande reaktionen.
(1 p.)
8.3 I en annan provuppställning studerades en blandning som var innesluten i ett slutet kärl på 5,00 liter vid temperaturen 500 K. Jämviktskoncentrationerna var c(CO) = 0,0104 mol/l, c(H₂O) = 0,0550 mol/l, c(CO₂) = 0,240 mol/l, c(H₂) = 0,240 mol/l. Blandningen upphettades till temperaturen 700 K och jämvikten fick infinna sig igen. Beräkna de nya jämviktskoncentrationerna vid temperaturen 700 K. Ange koncentrationerna med tre gällande siffrors noggrannhet. 6 p.
Vi ställer upp jämvikten:
| CO(g) + | H₂O(g) | ⇌ | CO₂(g) | + H₂(g) | |
|---|---|---|---|---|---|
| I början [mol/l] (500 K) | 0,0104 | 0,0550 | 0,240 | 0,240 | |
| Förändring 500 K → 700 K | +x | +x | –x | –x | |
| I jämvikt [mol/l] (700 K) | 0,0104 + x | 0,0550 + x | 0,240 – x | 0,240 – x |
(2 p.)
Jämviktskonstantens värde har avlästs rätt ur materialet vid temperaturen 700 K.
(1 p.)
Uttrycket för jämviktskonstanten, lösningen av ekvationen och jämviktskoncentrationerna:
K=\frac{[0{,}240-x]\cdot[0{,}240-x]}{[0{,}0104+x]\cdot[0{,}0550+x]}=9{,}23
- Om det förekommer principfel i lösningen av uttrycket för K, ej-FF till slutdelen av räkningen och max de 3 första poängen för uppgiften.
8,23x2 + 1,083642x − 0,05232044 = 0
x = 0,0375649 (eller x = −0,169235)
(1 p.)
[CO] = 0,0479649 mol/l ≈ 0,0480 mol/l
[H2O] = 0,0925649 mol/l ≈ 0,0926 mol/l
och [CO2] = [H2] = 0,2024351 mol/l ≈ 0,202 mol/l
(2 p.)
- Om svarets siffernoggrannhet avviker från tre gällande siffror, −1 p.
Del 3: 20-poängsuppgifter
9. Kemin för betablockerare 20 p.
9.1 I skede a) av reaktionsserie I används kaliumkarbonat som bildar en basisk vattenlösning. Hur reagerar 1-naftol i den här basiska vattenlösningen innan epiklorhydrin har tillsatts? Vad skulle frigöras till vattenlösningen i reaktionen i skede a) om kaliumkarbonat inte användes? 3 p.
1-naftol är en fenol som är en svag syra. 1-Naftol reagerar via en protonöverföringsreaktion i en basisk vattenlösning, och dess konjugerade bas (naftolatjonen) bildas.
(2 p.)
Utan kaliumkarbonat skulle vätekloridsyra (HCl) frigöras i reaktionen.
(1 p.)
9.2 I skede b) av reaktionsserie I reagerar mellanprodukten E med aminen F. Varför är den funktionella gruppen som reagerar i förening E ovanligt reaktiv? 2 p.
Etergruppen i föreningen E finns i ringen med tre atomer
(1 p.)
som är en spänd struktur (bindningsvinklarna avviker från de ideala). Därför är den reaktiv.
(1 p.)
9.3 Varför måste man använda överskott av aminen F i skede c) av reaktionsserie II? 3 p.
I reaktionen bildas också HBr
(1 p.)
som reagerar med aminen.
(1 p.)
Slutsats gällande orsaken till att man använder ett överskott av aminen, någon aspekt från följande lista (slutsatspoänget förutsätter att bildandet av HBr framgår ur svaret):
- För att utgångsämne G ska reagera till slut
- En del av aminen förbrukas i neutralisationsreaktionen
- Eftersom HBr frigörs förbrukas det mer av aminen i reaktionen
(1 p.)
9.4 (R)- och (S)-propranolol är varandras enantiomerer. I reaktionsserie II bildas (S)-propranolol som huvudprodukt, och dess stereokemi visas i bilden . Däremot bildas det (S)- och (R)-propranolol i reaktionsserie I. Varför bildas det inte enbart (S)-propranolol i reaktionsserie I? Hur mycket av propranololen i reaktionsserie I är (S)-propranolol? Motivera ditt svar. 4 p.
Utgångsämnet epiklorhydrin är rasemiskt, så båda enantiomererna förekommer i förhållandet 1:1. / I reaktionsserie 1 används inte någon kiral katalysator som skulle möjliggöra att endast den ena enantiomeren bildas.
(2 p.)
Då är också produkten rasemisk, så reaktionsseriens propranolol består till 50 % av (S)-propranolol.
(2 p.)
9.5 Studera material . Förklara i ord eller genom att rita en bild hur strukturen hos den dominerande formen av propranolol skiljer sig vid pH-värdena 3 och 11. Varför är log D större vid pH-värdet 11 än vid pH-värdet 3? Du kan utnyttja strukturformeln i ditt svar. 8 p.
I allmänhet gäller att ju mindre log D är, desto mer vattenlöslig är föreningen.
(2 p.)
Aminogruppen i propranolol kan protoneras
(1 p.)
- Om aminogruppens benägenhet att protoneras inte framgår ur svaret, ej-FF och sammanlagt de första 2 poängen för uppgiften.
Vid ett surt pH-värde (pH 3) är propranololens aminogrupp protonerad och har en positiv delladdning.
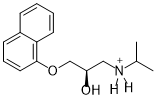 Den protonerade formen av propranolol
Den protonerade formen av propranolol
(1 p.)
I en basisk lösning (pH 11) är propranololens aminogrupp inte protonerad.
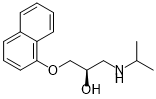 Propranolol som inte är protonerad
Propranolol som inte är protonerad
(1 p.)
Aminogruppen i propranolol är joniserad och den protonerade syraformen är mer polär än basformen.
(2 p.)
Därför löser sig propranolol i syraformen bättre i vatten än propranolol i basformen.
(1 p.)
Därför är log D-värdet mindre vid låga pH-värden och större vid höga pH-värden.
10. Buffertförmågan hos en buffertlösning 20 p.
10.1 En buffertlösning framställs av en salpetersyrlighetslösning och en natriumnitritlösning. Mellan vilka pH-värden fungerar den som buffertlösning? Motivera ditt svar med beräkningar. 4 p.
Ur tabellboken erhålls salpetersyrlighets Kₐ = 7,2 · 10–4 mol/dm³
(1 p.)
K_a=\mathrm{\frac{[H_3O^+][A^-]}{[HA]}}{{,}}\ \mathrm{och\ vi\ får\ [H_3O^+]} = K_a\mathrm{\frac{[HA]}{[A^-]}\ och\ pH}=-\lg\left(K_a\mathrm{\frac{[HA]}{[A^-]}}\right)
Här används beteckningen HNO₂ = HA och NO₂⁻ = A⁻.
Förhållandet [HA]/[A⁻] ska vara inom intervallet 0,1–10, och då är
pHmin = − lg (Kₐ · 10) = 2,14
pHmax = − lg (Kₐ · 0,10) = 4,14
ELLER
Genom att använda Henderson-Hasselbalch-formeln:
pHmin = pKₐ + lg(0,1) = 3,14 − 1 = 2,14
pHmax = pKₐ + lg(10) = 3,14 + 1 = 4,14
(2 p.)
Svar: pH-värdet ska vara inom intervallet 2,14–4,14.
(1 p.)
10.2 En fosfatbuffert som framställts av fosforsyra används ofta i biologiska tillämpningar för att upprätthålla det rätta pH-värdet, eftersom råmaterialen för denna buffert inte är giftiga för cellerna och de är billiga. Inne i cellen är pH-värdet i medeltal ca 7,4. Vid det här pH-värdet förekommer fosforsyran inne i cellerna som jonerna \mathrm{H_2PO_4^-} (39 %) och \mathrm{HPO_4^{2-}} (61 %). Vad händer i den här buffertlösningen då man gradvis tillsätter allt mera syra eller bas? 6 p.
Reaktionerna har beskrivits i ord eller med reaktionsformler:
- Tillsats av syra (H⁺):
Vätejonen reagerar med en monovätefosfatjon (1 p.) och det bildas divätefosfatjon: (1 p.)
ELLER
Uttryckt med en reaktionsformel:
\mathrm{HPO_4^{2-}(aq)+H^+(aq)\ \rightarrow\ H_2PO_4^-(aq)}
(2 p.)
- Tillsats av bas:
Basen/hydroxidjonen reagerar med en divätefosfatjon (1 p.) och det bildas monovätefosfatjon och vatten. (1 p.)
ELLER
Uttryckt med en reaktionsformel:
\mathrm{H_2PO_4^-(aq)+OH^-(aq)\ \rightarrow\ HPO_4^{2-}(aq)+H_2O(l)}
(2 p.)
Beskrivning av hur pH förändras samt motivering:
(Det bildas en svag bas (\mathrm{HPO_4^{2-}}) eller en svag syra (\mathrm{H_2PO_4^-}) i neutralisationsreaktionen, vilka protolyseras bara i låg grad.)
I början förändras pH bara lite.
(1 p.)
Buffertförmågan har beaktats:
Då man tillsätter så mycket bas eller syra att förhållandet mellan syraformen och den konjugerade basen [\mathrm{H_2PO_4^-}]:[\mathrm{HPO_4^{2-}}] är större än 10 eller mindre än 0,1 kan lösningen inte längre buffra den tillsatta syran eller basen. Då förändras pH kraftigt.
(1 p.)
10.3 Man använder ofta två buffertlösningar med pH-värdena 4,00 och 7,00 (t = 25 °C) för att kalibrera pH-mätare. Varför använder man inte bara vatten för att kalibrera en pH-mätare vid pH-värdet 7,00? 3 p.
Vatten kan inte fungera som en buffertlösning. / Vattnets pH bevaras inte vid värdet 7,00. / Små orenheter kan förändra vattnets pH-värde.
(1 p.)
Rent vattens pH-värde beror på temperaturen.
(1 p.)
Då vatten lagras löser sig alltid en viss mängd koldioxid ur luften i vattnet.
(1 p.)
Koldioxiden ger upphov till kolsyra i vattnet.
(1 p.)
Då är lösningens pH-värde inte exakt 7,00. En buffertlösning kan neutralisera kolsyran som bildas av koldioxiden.
10.4 En studerande framställde en buffertlösning genom att lösa upp 0,273 g natriumacetat i vatten och tillsätta 13,0 ml ättiksyra med koncentrationen 0,250 mol/dm³. Lösningens totalvolym var 100,0 ml. Studeranden ville undersöka lösningens buffertkapacitet. Kaliumhydroxid (KOH) i formen av fasta korn löstes upp i lösningen, ett korn i taget. Massan för ett KOH-korn var 0,06 g. Hur många hela KOH-korn måste man minst tillsätta till lösningen för att den ska förlora sin buffertförmåga? Motivera ditt svar med beräkningar. Vi antar att alla KOH-korn hade samma massa och att tillsatsen av KOH-korn inte påverkade lösningens volym. 7 p.
M(CH₃COONa) = 82,034 g/mol
n(CH₃COO⁻, början) = n(CH₃COONa, början)
= m(CH₃COONa)/M(CH₃COONa) = 0,273 g/(82,034 g/mol) = 0,00332789 mol
(1 p.)
n(CH₃COOH, början) = 0,0130 l · 0,250 mol/l = 0,0032500 mol
(1 p.)
I ett KOH-korn finns
n(KOH, korn) = m(KOH) / M(KOH) = 0,06 g / (56,108 g/mol) = 0,001069 mol.
Då man tillsätter KOH som är en bas reagerar den med ättiksyran CH₃COOH:
OH⁻(aq) + CH₃COOH(aq) → CH₃COO⁻(aq) + H₂O(l).
Då minskar substansmängden av syraformen och substansmängden av basformen ökar:
(1 p.)
- Om den här principen inte har beaktats i beräkningarna, ej-FF (och då totalt de 2 första poängen för uppgiften)
n(CH₃COOH, ny) = n(CH₃COOH, början) – x · n(KOH, korn)
n(CH₃COO⁻, ny) = n(CH₃COO⁻, början) + x · n(KOH, korn).
(1 p.)
Acetatjonernas koncentration ska vara mer än tio gånger så stor som syraformens koncentration. Eftersom volymen är konstant kan vi beräkna antalet KOH-korn med hjälp av substansmängderna:
n(CH₃COO⁻, ny) > 10 · (n(CH₃COOH, ny)).
(1 p.)
Vi sätter in uttrycken för substansmängderna i olikheten och låter x representera antalet tillsatta korn:
n(CH₃COO⁻, början) + x · n(KOH, korn) > 10 · (n(CH₃COOH, början) − x · n(KOH, korn))
x · n(KOH, korn) + 10 x · n(KOH, korn) > 10 · n(CH₃COOH, början) − n(CH₃COO⁻, början)
x > (10 · n(CH₃COOH, början) − n(CH₃COO⁻, början)) / (11 · n(KOH, korn))
x > (10 · 0,0032500 mol − 0,00332789 mol) / (11 · 0,001069 mol)
x > 2,48
(1 p.)
Svar: Man måste sätta till minst tre hela KOH-korn för att lösningen ska förlora sin buffertförmåga. (1 p.)
11. Proteiner och peptider 20 p.
11.1 Oxytocin är ett litet peptidhormon som består av nio aminosyror. Det kan användas för att sätta igång en förlossning. Studera strukturen som visas i material och skriv ut aminosyrorna som finns mellan Cys1 och Cys6 i ordningsföljd. Börja med cysteinet Cys1. Skriv aminosyrorna med hjälp av förkortningar på tre bokstäver. 6 p.
Kedjan är Cys-Tyr-Ile-Gln-Asn-Cys.
(1 p./rätt aminosyra, 2 p. rätt ordning; då förutsätts att alla fyra aminosyror är rätt)
- Om överlopps aminosyror har nämnts i svaret, −1 p./aminosyra och då erhålls inte poängen för ordningsföljden.
11.2 Vilken växelverkan har markerats med en streckad linje i bild ? Hur binds aminosyrorna Cys1 och Cys6 till varandra? Hur inverkar den växelverkan som markerats med en streckad linje samt bindningen mellan aminosyrorna Cys1 och Cys6 på veckningen av oxytocin? 5 p.
Det är fråga om en vätebindning. Den stabiliserar konformationen som visas i bilden.
Den gula strukturen är en svavelbrygga / disulfidbindning / kovalent bindning mellan två svavelatomer. Svavelbryggan finns mellan två cysteiner. Svavelbryggan låser molekylen till en ringform.
Poängsättning:
- identifiering av bindningarna: 1 rätt 2 p., båda rätt 3 p.
- Inverkan på rymdstrukturen 2 p. (poängen för inverkan förutsätter att bindningen har identifierats), 1 p. / inverkan:
- Vätebindningen/Svavelbryggan stärker / stabiliserar den tredimensionella strukturen / den tredimensionella formen / rymdstrukturen.
- Vätebindningen/Svavelbryggan bevarar/stabiliserar formen som krävs för receptorn / funktionen / aktiviteten.
- Vätebindningen/Svavelbryggan låser molekylen/ gör molekylen styvare / stabiliserar molekylen / motsvarande uttryck. Istället för molekylen kan man skriva strukturen / veckningen.
- Svavelbryggan låser molekylen till en ring.
11.3 I bild visas strukturen för insulin. I bilden har proteinets sekundärstruktur märkts ut med ett brett rött och ett smalt grått band. Vad heter sekundärstrukturen som är utmärkt med ett brett rött band i bilden? Vilka andra sekundärstrukturer förekommer allmänt i proteiner? 3 p.
Sekundära strukturer är α-helixar samt β-strängar och β-flak. Sekundärstrukturen som representeras av ett brett rött band är en α-helix.
Poängsättning:
- α-helixen är identifierad och placerad rätt, 2 p.
- därtill förekommer β-flak, 1 p.
11.4
Kollagen är ett viktigt bindvävsprotein. För att kollagen ska bildas måste en aminosyra i ett protein modifieras genom oxidation. Oxidationen katalyseras av ett enzym som är beroende av C-vitamin för att fungera. En långvarig C-vitaminbrist leder till skörbjugg, och då skadas människans bindväv, tandköttet drar sig tillbaka och huden börjar blöda.
I material visas en kul- och pinnmodell av en del av kollagenets aminosyrakedja. Kollagen består av prolin, glycin och en tredje aminosyra som inte hör till de 20 vanligaste aminosyrorna i naturen. Just den här aminosyran bildas med hjälp av en enzymatisk oxidationsreaktion av ett protein. Framställ strukturformeln för denna tredje aminosyra. Rita strukturformeln så att aminosyrans asymmetriska kolatomers stereokemi, alltså bindningarnas riktningar i rymden, framgår.
6 p.
Den tredje aminosyran är
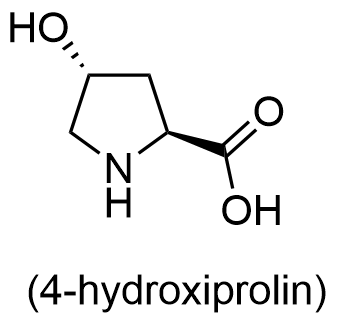 Strukturen för 4-hydroxiprolin
Strukturen för 4-hydroxiprolin
Poängsättning:
- de funktionella grupperna rätt 3 p.
- den rätta ställningsisomeren 1 p. (förutsätts att alla föregående poäng har ansamlats)
- i bilden visas trans-isomeren 1 p. (förutsätts att alla föregående poäng har ansamlats)
- den rätta enantiomeren visas 1 p. (förutsätts att alla föregående poäng har ansamlats)