Hyvän vastauksen piirteet: FI – Kemia
14.9.2022
Lopulliset hyvän vastauksen piirteet 10.11.2022
Lopullisista hyvän vastauksen piirteistä ilmenevät perusteet, joiden mukaan koesuorituksen lopullinen arvostelu on suoritettu. Tieto siitä, miten arvosteluperusteita on sovellettu kokelaan koesuoritukseen, muodostuu kokelaan koesuorituksestaan saamista pisteistä, lopullisista hyvän vastauksen piirteistä ja lautakunnan määräyksissä ja ohjeissa annetuista arvostelua koskevista määräyksistä. Lopulliset hyvän vastauksen piirteet eivät välttämättä sisällä ja kuvaa tehtävien kaikkia hyväksyttyjä vastausvaihtoehtoja tai hyväksytyn vastauksen kaikkia hyväksyttyjä yksityiskohtia. Koesuorituksessa mahdollisesti olevat arvostelumerkinnät katsotaan muistiinpanoluonteisiksi, eivätkä ne tai niiden puuttuminen näin ollen suoraan kerro arvosteluperusteiden soveltamisesta koesuoritukseen.
Ylioppilastutkinnon kokeessa selvitetään, ovatko opiskelijat omaksuneet lukion opetussuunnitelman mukaiset tiedot ja taidot sekä saavuttaneet lukiokoulutuksen tavoitteiden mukaisen riittävän kypsyyden. Kemian kokeessa arvioinnin kohteina ovat kemiallisen tiedon ymmärtäminen ja soveltaminen. Arvioinnissa otetaan huomioon myös kokeellisen tiedonhankinnan ja ‐käsittelyn taidot. Näihin kuuluvat esimerkiksi kokeiden suunnittelu, työvälineiden ja reagenssien turvallinen käyttö, tulosten esittäminen ja tulkitseminen sekä johtopäätösten tekeminen ja soveltaminen.
Kemian tehtäviä arvosteltaessa painotetaan oppiaineen luonteen mukaista esitystapaa sekä käsitteiden ja kielenkäytön täsmällisyyttä. Reaktioyhtälöt esitetään ilman hapetuslukuja pienimmin mahdollisin kokonaislukukertoimin ja olomuodoilla varustettuna. Orgaanisissa reaktioyhtälöissä käytetään rakennekaavoja, mutta olomuotoja ei tarvitse mainita. Rakennekaavojen eri esitystavat hyväksytään.
Laskennallisissa tehtävissä suureyhtälöjä ja kaavoja käytetään tavalla, joka osoittaa kokelaan ymmärtäneen tehtävänannon oikein ja soveltaneen ratkaisussaan asianmukaista periaatetta tai lakia. Vastauksesta ilmenee yksiselitteisesti, miten lopputulokseen päädytään, mutta laajoja välivaiheita ei tarvita. CAS-ohjelmia voi hyödyntää tehtävän eri vaiheissa. Merkintätapojen kannalta keskeisiä vaiheita ovat periaatteiden ja lakien sekä lopputuloksen ja johtopäätösten esittäminen. Lopputulokset annetaan lähtöarvojen mukaisella tarkkuudella yksiköineen ja johtopäätökset perustellaan.
Mittaustuloksia ja niistä piirrettyjä kuvaajia hyödynnetään tiedon analysoinnissa ja johtopäätösten tekemisessä. Mittauspisteisiin sovitetaan asianmukainen suora tai käyrä esimerkiksi jonkin sovitefunktion avulla. Jos mittauspisteet ovat lähellä toisiaan, varsinaista sovitefunktiota ei tarvitse lisätä. Mittauspisteiden välisiä arvoja voi interpoloida kuvaajaa silmämääräisesti lukemalla tai sopivalla ohjelmalla. Kuvaajaan merkitään akselien nimet, yksiköt ja asteikko. Kuvaajaan merkitään johtopäätösten kannalta olennaiset kohdat, kuten titrauskäyrän ekvivalenttikohta tai hetkellistä nopeutta laskettaessa kyseinen tangentti.
Essee‐ ja selittävissä vastauksissa tekstiä täydennetään reaktioyhtälöillä, kaavoilla tai piirroksilla. Käsiteltäviä ilmiöitä kuvataan makroskooppisella, mikroskooppisella ja symbolisella tasolla. Vastauksesta ilmenee, että tehtävään liittyvää aineistoa on hyödynnetty, sovellettu, analysoitu ja arvioitu tehtävänannon mukaisesti. Hyvä vastaus on jäsennelty ja sisällöltään johdonmukainen.
Vastaus arvostellaan tehtäväkohtaisten kriteerien mukaisesti. Lähtökohtana ovat vastauksen ansiot, joista kertyy pisteitä. Jos keskeinen kemiallinen periaate puuttuu tai se on virheellinen, pisteiden kertyminen päättyy. Tällöin virheellisen tuloksen siirtymistä eteenpäin ei hyväksytä (ei-VSE). Muiden puutteiden tai virheiden kohdalla virheellisen tuloksen siirtyminen eteenpäin hyväksytään (VSE), jolloin pisteiden kertyminen jatkuu puutteen tai virheen jälkeen. Kokeen loppupään vaativat tehtävät edellyttävät täsmällisempää periaatteiden hallintaa kuin kokeen alkupään perustehtävät. Kemian kannalta epätäsmällisestä kielenkäytöstä, pienestä laskuvirheestä tai likiarvojen huolimattomasta käytöstä vähennetään 0–3 p.
Osa 1: 20 pisteen tehtävä
1. Monivalintatehtäviä kemian eri osa-alueilta 20 p.
1.1 Millä seuraavista yhdisteistä on suurin liukoisuus veteen lämpötilassa 20 °C? 2 p.
- (C₂H₅)₂NH (2 p.)
1.2 Millä seuraavista alkoholeista esiintyy enantiomeriaa (optista isomeriaa)? 2 p.
- butan-2-oli (2 p.)
1.3 Kuinka monta dibromibentseenin paikkaisomeeriä voi olla olemassa? 2 p.
- 3 (2 p.)
1.4 Mikä seuraavista metalleista reagoi kiivaimmin veden kanssa? 2 p.
- K (2 p.)
1.5 Glysiinin kantaliuoksen konsentraatio on 1,00 · 10–4 mol/dm3. Siitä valmistetaan 100,0 ml glysiiniliuosta, jonka konsentraatio on 1,20 · 10–7 mol/dm3. Paljonko kantaliuosta on pipetoitava 100 ml:n mittapulloon? 2 p.
- 120 μl (2 p.)
1.6 Millä seuraavista tavoista voidaan valmistaa propan-2-olia? 2 p.
- liittämällä vettä propeeniin (2 p.)
1.7 Happea ja tuntematonta kaasua X punnittiin sama ainemäärä erikseen samassa pullossa. Molemmissa mittauksissa paine ja lämpötila olivat samat. Taulukossa on esitetty punnitustulokset. 2 p.
| punnitustulos (g) | |
| Pullo | 124,46 |
| Pullo + happi | 125,10 |
| Pullo + kaasu X | 125,34 |
Mikä oli tuntemattoman kaasun X moolimassa?
- 44 g/mol (2 p.)
1.8 Mikä seuraavista väittämistä pitää paikkansa tietystä ainemäärästä ideaalikaasua? 2 p.
- Kaasun tilavuuden pienentäminen kasvattaa sen painetta vakiolämpötilassa. (2 p.)
1.9 Mikä kuvan nuolista A, B, C tai D kuvaa reaktion aktivaatioenergiaa? 2 p.
- A (2 p.)
1.10 Tarkastellaan reaktiota
2SO₂(g) + O₂(g) → 2SO₃(g)
Muodostumislämmöt ovat:ΔHf(SO₂(g)) = −296,9 kJ/mol
ΔHf(O₂(g)) = 0 kJ/mol
ΔHf(SO₃(g)) = −395,2 kJ/mol
- −196,6 kJ (2 p.)
Osa 2: 15 pisteen tehtävät
2. Kaliummangaanitrifluoridin synteesi 15 p.
3KF(aq) + MnCl₂(aq) → KMnF₃(s) + 2KCl(aq).
Saatu saostuma suodatetaan suodatinpaperille ja pestään ensin vedellä, ja sen jälkeen etanolilla ja asetonilla. Saostuma kuivataan lämpökaapissa 100 °C:ssa, jäähdytetään eksikaattorissa ja punnitaan.
Opiskelijoiden tavoitteena oli valmistaa 8,500 grammaa KMnF₃:a.
2.1 Opiskelijat olettivat, että lähtöaineiden puhtaus ja synteesin saanto ovat 100 %. Kuinka monta grammaa lähtöaineita KF ja MnCl₂·4H₂O he punnitsivat? 8 p.
n(KMnF₃) = m/M = 8,500 g / (151,04 g/mol) = 0,0562765 mol
(2 p.)
n(MnCl₂·4H₂O) = n(MnCl₂) = n(KMnF₃) = 0,0562765 mol
(1 p.)
m(MnCl₂·4H₂O) = n · M = 0,056276 mol · 197,904 g/mol
= 11,137 g ≈ 11,14 g
(2 p.)
- Jos kidevesi huomioimatta, 0 p.
n(KF) = 3 · n(KMnF₃) = 0,168830 mol
(2 p.)
m(KF) = n · M = 0,168830 mol · 58,10 g/mol = 9,80899 g ≈ 9,809 g
(1 p.)
2.2 Opiskelijoiden synteesituotteen massa oli 8,235 g. Arvioi, mitkä tekijät voivat pienentää tuotteen massaa. 2 p.
Tekijöitä, jotka voivat pienentää tuotteen massaa (1 p./tekijä):
- Lähtöaineiden puhtaus ei ole ollut sataprosenttinen.
- Reaktio ei ole tapahtunut täydellisesti.
Seuraavista 1 p./tekijä, maks. 1 p.:
- Kaikkea tuotetta ei ole saatu suodatettua.
- Tuotetta on hävinnyt suodatusvaiheessa.
- Lähtöaineita on jäänyt astioihin.
- On käytetty vääränlaista suodatinpaperia, joka päästää saostumaa suodokseen.
- Saostumaa on jäänyt suodatinpaperille.
- Kun saostumaa pestään, osa tuotteesta on saattanut huuhtoutua/liueta pois.
- Suodatuspaperi ei ole ollut tarpeeksi tiiviisti ja osa saostumasta on valunut pulloon.
- Lähtöaineiden tai tuotteen punnituksessa on tapahtunut virhe.
Seuraavista tekijöistä ei ansioita:
- Laskuvirheet
- Muut inhimilliset virheet
2.3 Opiskelijoiden syntetisoimaa tuotetta analysoitiin pulveriröntgendiffraktiolla. Analyysin mukaan tuote, jota saatiin 8,235 g, oli seos, jossa oli 92,8 m-% KMnF₃:ia ja 7,2 m-% KCl:ia. Mikä oli KMnF₃:in todellinen saantoprosentti? Miksi tuotteessa oli myös KCl:ia? 5 p.
Todellinen m(KMnF₃) = 0,928 · 8,235 g = 7,64208 g.
(1 p.)
Todellinen saanto oli (7,64208 g / 8,500 g) · 100 % = 89,9068 % ≈ 89,9 %.
(2 p.)
Saostuman pesu oli epäonnistunut.
TAI
Kaikkea KCl-liuosta ei ollut saatu pestyä pois saostuman pinnalta.
(2 p.)
3. Kemialliset sidokset 15 p.
3.1 Natriumkloridin vesiliuoksen sähkönjohtokyky on huomattavasti parempi kuin kiinteän natriumkloridin. 5 p.
NaCl(aq):ssa ionit ovat hydratoituneina akvaioneina.
(1 p.)
Tällöin ne pääsevät liikkumaan vesiliuoksessa ja toimimaan varauksenkuljettajina.
(2 p.)
NaCl(s):ssa on ionihila, jossa ioneilla on tietyt paikat.
Hilarakenteessa ei ole vapaasti liikkuvia varauksia.
(2 p.)
- Elektroneja ei hyväksytä varauksenkuljettajina.
3.2 Polypropeenilla ei ole tarkkaa sulamispistettä, vaan kuumennettaessa se pehmenee asteittain laajalla lämpötila-alueella. Sen sijaan asetyylisalisyylihapon eli aspiriinin tarkka sulamispiste voidaan määrittää. 5 p.
Sulaminen liittyy molekyylien välisten heikkojen sidosten katkeamiseen.
(1 p.)
Polypropeenimolekyylit eivät muodosta säännöllistä hilarakennetta. Tämän vuoksi polypropeenimolekyylien välisten vuorovaikutusten voimakkuus ei ole samansuuruinen kaikkialla aineessa. Molekyylien välisten heikkojen sidosten katkaisemiseen tarvittava energia vaihtelee. Siksi polypropeeni pehmenee laajalla lämpötila-alueella.
(2 p.)
Kiinteä asetyylisalisyylihappo on kiteinen. / Kiinteän asetyylisalisyylihapon molekyylit ovat järjestyneet (molekyyli)hilaksi.
Molekyylien väliset vuorovaikutukset ovat samansuuruisia kaikkialla hilassa. Siksi asetyylisalisyylihapolla on tarkka sulamispiste.
(2 p.)
3.3 Huoneenlämpötilassa (25 °C) piidioksidi SiO₂ on kiinteä aine, mutta hiilidioksidi CO₂ on kaasumaista. 5 p.
SiO₂:ssa jokainen Si-atomi on kovalenttisesti kiinnittynyt neljään O-atomiin muodostaen kovalenttisen hilan, jonka atomit ovat vahvoilla sidoksilla kiinni toisissaan.
(2 p.)
CO₂ koostuu erillisistä CO₂-molekyyleistä. Molekyylien välillä on vain heikkoja dispersiovoimia.
(2 p.)
Verrattuna dispersiovoimiin, kovalenttisten sidosten katkaisu vaatii enemmän energiaa.
(1 p.)
- Energiavertailusta ei saa pisteitä, jos SiO₂ on kuvattu molekyylinä tai ioniyhdisteenä.
4. Kipua lievittävä opioidi 15 p.
4.1 Fentanyylin rakenteeseen on merkitty funktionaaliset ryhmät I ja II. Mihin yhdisteryhmään fentanyyli kuuluu funktionaalisen ryhmän I perusteella ja mihin yhdisteryhmään funktionaalisen ryhmän II perusteella? 2 p.
I: amiini (1 p.)
II: amidi (1 p.)
4.2 Yksi fentanyylin valmistustapa on esitetty aineiston reaktiosarjassa. Esitä lähtöaineen L ja välituotteen N rakenteet. 4 p.
4.3
Kun fentanyyli liukenee veteen, tapahtuu aineistossa kuvattu reaktio.
Fentanyylin emäsvakio Kb on 9,77 · 10–6 mol/l.
Mikä on muodostuneen fentanyyliliuoksen pH-arvo, kun 198,9 mg fentanyyliä liuotetaan mittapullossa veteen niin, että liuoksen lopputilavuus on 100,0 ml?
9 p.
m(fentanyyli) = 198,9 mg
M(fentanyyli) = (22 · 12,01 + 28 · 1,008 + 2 · 14,01 + 1 · 16,00) g/mol = 336,464 g/mol
n = m / M = 0,1989 g / (336,464 g/mol) = 5,911479 · 10–4 mol
c = n / V = 5,911479 · 10–4 mol / 0,1000 dm3 = 5,911479 · 10–3 mol/dm3
(3 p.)
Tasapainotarkastelu:
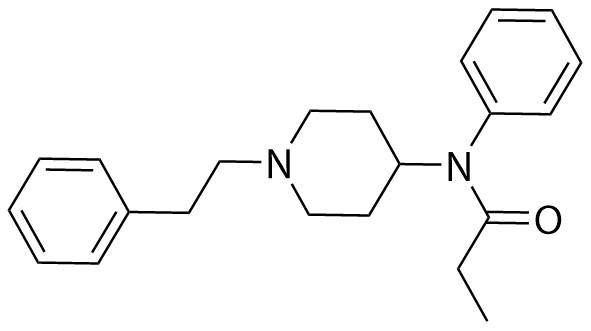 Kuva: lähtöaineen rakenne Kuva: lähtöaineen rakenne | H₂O | ⇌ | 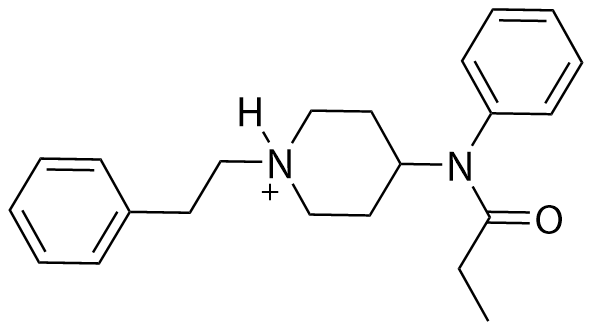 Kuva: tuotteen rakenne Kuva: tuotteen rakenne | OH⁻ | |
| Lähtötilanne (mol/dm³): | 5,911479 · 10–3 | - | 0 | 0 | |
| Tasapaino (mol/dm³): | 5,911479 · 10–3 − x | - | x | x |
(2 p.)
Kb = x² / (5,911479 · 10–3 − x) = 9,77 · 10–6
x₁ = 0,00023549 ja x₂ = −0,00024526
(2 p.)
Negatiivinen juuri ei kelpaa.
pOH = −lg 0,00023549 = 3,6280
pH = 14 – 3,6280 = 10,3720 ≈ 10,372
(2 p.)
Vastaus: Syntyneen liuoksen pH-arvo oli 10,372.
5. Pentaerytritolin valmistus 15 p.
5.1 Kirjoita tasapainotettu reaktioyhtälö olomuotomerkintöineen. Aineet voi esittää molekyyli- tai rakennekaavoina. 4 p.
CH₃CHO(aq) + 4CH₂O(aq) + OH⁻(aq) → C(CH₂OH)₄(aq) + HCOO⁻(aq)
TAI
C₂H₄O(aq) + 4CH₂O(aq) + OH⁻ (aq) → C₅H₁₂O₄(aq) + HCOO⁻(aq)
TAI
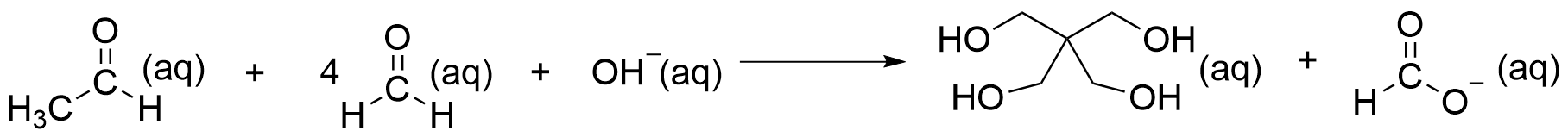 Kuva: reaktioyhtälö esitettynä rakennekaavoilla
Kuva: reaktioyhtälö esitettynä rakennekaavoilla
Pisteytys:
Oikeat aineet, 1 p.
Oikeat kertoimet, 2 p.
Oikeat olomuodot, 1 p.
- Virheelliset tiivistetyt rakennekaavat, joissa on oikea määrä atomeja: 0 p. aineista, mutta VSE.
- Väärä määrä atomeja yhdisteessä tai virheellinen varaus: 0 p. koko osatehtävästä.
5.2 Aineistossa on esitetty etanaalin ja metanaalin ¹H-NMR-spektrit Q ja R. Kumpi spektreistä Q ja R kuvaa etanaalia ja kumpi metanaalia? Perustele vastauksesi. 5 p.
Q kuvaa etanaalia ja R metanaalia.
(1 p.)
Molemmissa spektreissä on alueella 9,5–10,0 ppm piikki, joka johtuu aldehydiryhmän vetyatomin ytimestä.
(2 p.)
Etanaalin spektrissä näkyy kuitenkin myös alueella 2,0–2,5 ppm piikki, joka johtuu CH₃–ryhmän vetyatomien ytimistä. Tätä piikkiä ei näy metanaalin spektrissä.
(2 p.)
- Kemiallinen siirtymä/piikki pitää olla kohdistettu vety-ytimeen tai vetyatomiin.
TAI
Q kuvaa etanaalia ja R metanaalia.
(1 p.)
Metanaalissa on vety-ytimiä/atomeja vain yhdenlaisessa kemiallisessa ympäristössä. Tämän takia metanaalin spektrissä näkyy yksi piikki.
(2 p.)
Etanaalissa vety-ytimiä on kahdenlaisessa kemiallisessa ympäristössä. Tämän takia etanaalin spektrissä näkyy kaksi piikkiä.
(2 p.)
- Kemiallinen siirtymä/piikki pitää olla kohdistettu vety-ytimeen tai vetyatomiin.
5.3 Pentaerytritolia valmistettiin tehtävän johdannossa esitetyn reaktion avulla. Lopputuote kiteytettiin, ja siitä mitattiin aaltolukualueella 1 500–3 800 cm–1 IR-spektri, joka on esitetty aineistossa . Perustele spektrin avulla, sisältääkö lopputuote pentaerytritolin lisäksi myös etanaalia tai metanaalia. 6 p.
Sekä metanaali että etanaali sisältävät aldehydiryhmän, jossa on C=O-sidos.
(2 p.)
Tämän sidoksen värähdykset näkyisivät IR-spektrissä selvästi alueella
1 700–1 750 cm–1.
(2 p.)
Spektrissä ei ole tällaista piikkiä, eli IR-spektrin perusteella lopputuotteessa ei ole epäpuhtautena lähtöaineita.
(2 p.)
6. Vetyfluoridin valmistusreaktio 15 p.
Vetyfluoridia valmistetaan vedystä ja fluorista seuraavan reaktioyhtälön mukaisesti:
H₂(g) + F₂(g) ⇌ 2HF(g).
6.1 Tietyssä lämpötilassa vetyfluoridin valmistusreaktion tasapainovakio K = 1,15 · 10². Reaktioastiaan, jonka tilavuus oli 1,50 litraa, lisättiin vetyä, fluoria ja vetyfluoridia. Jokaista kaasua oli 3,00 mol. Mihin suuntaan reaktio eteni? Perustele vastauksesi. Mitkä olivat kaasujen konsentraatiot dynaamisessa tasapainotilassa? 9 p.
Alkukonsentraatiot: 3,00 mol / 1,50 l = 2,00 mol/l
(1 p.)
K = [HF]² / ([H₂] [F₂])
(1 p.)
Lasketaan tasapainovakion lausekkeessa käytetty osamäärä käyttäen lähtökonsentraatioita:
[HF]₀² / ([H₂]₀[F₂]₀) = (2,00 mol/l)² / (2,00 mol/l · 2,00 mol/l) = 1 << K = 115.
Reaktio ei ole vielä saavuttanut tasapainoasemaa, vaan lähtöaineita on ylimäärin. Reaktio etenee siis tuotteisiin päin.
(2 p.)
- Vastauksessa pitää viitata reaktio-osamäärän arvoon.
Tarkastellaan tasapainotilannetta:
| H₂ | + | F₂ | ⇌ | 2 HF | |
| alku (mol/l) | 2,00 | 2,00 | 2,00 | ||
| tasapaino (mol/l) | 2,00 − x | 2,00 − x | 2,00 + 2x |
(2 p.)
K = (2,00 + 2x)² / (2,00 − x)² = 115
(2 + 2x) / (2 − x) = (115)1/2
x₁ = 1,52844 ja x₂ = 2,68777
(1 p.)
Tasapainossa
[HF] = 5,0569 mol/l ≈ 5,06 mol/l
[H₂] = [F₂] = 0,47156 mol/l ≈ 0,472 mol/l.
(2 p.)
6.2 Miten vetyfluoridia voidaan tuottaa teollisessa prosessissa mahdollisimman tehokkaasti tehtävässä annetun reaktion avulla? Vetyfluoridin muodostumislämpö ∆Hf = −273,3 kJ/mol. Perustele vastauksesi. 6 p.
Tarkastellaan erilaisia tapoja tuottaa vetyfluoridia mahdollisimman tehokkaasti. Tavan ja sen seurauksen mainitseminen, 1 p., ja sen perustelu 1 p., yht. 6 p.
Saannon parantaminen tasapainoon vaikuttamalla
- Tapa: Lämpötilan laskeminen siirtää tasapainotilaa tuotteisiin päin. Perustelu: Muodostumislämmön perusteella reaktio on eksoterminen. Lämpötilan laskeminen siirtää tasapainotilaa reaktion eksotermiseen suuntaan.
- Jos tasapainon siirtyminen ja reaktion nopeutuminen sekoitettu, 0 p.
- Tapa: Poistetaan vetyfluoridia reaktioastiasta / syötetään lähtöaineita reaktoriin. Perustelu: Poistamalla tuotetta / lisäämällä lähtöaineita tasapainotilaa ei saavuteta, vaan tuotetta muodostuu lisää niin kauan kuin tuotteita poistetaan prosessista / lähtöaineita syötetään prosessiin.
Reaktion nopeuttaminen
- Tapa: Lämpötilan nostaminen nopeuttaa reaktiota. Perustelu: Korkeammassa lämpötilassa rakenneosien kineettinen energia on suurempi kuin matalassa lämpötilassa. Tällöin suotuisia, reaktioon johtavia törmäyksiä, tapahtuu enemmän.
- Tapa: Lähtöaineiden lisääminen nopeuttaa reaktiota. Perustelu: Se lisää reaktioon johtavia törmäyksiä.
- Tapa: Käytetään katalyyttiä. Perustelu: katalyytin käyttö laskee aktivoitumisenergiaa ja nopeuttaa reaktiota.
- Tapa: Paineen kasvattaminen astian tilavuutta pienentämällä nopeuttaa reaktiota. Perustelu: Lisää reaktioon johtavia törmäyksiä.
- Jos paineen vaikutus tasapainotilaan päätelty virheellisesti, -1 p.
Yhteisvaikutukset, maks. 1 p.
- Käsitellään eksplisiittisesti lämpötilan vaikutusta reaktion optimointiin ottaen huomioon sekä tasapainon että reaktionopeuden erilaiset vaikutukset huomioimalla.
7. Sähkökemiallinen pari 15 p.
7.1 Esitä kuvan sähkökemiallisen parin kennokaavio. 4 p.
− Zn(s) │ Zn²⁺(aq) ││ Cu²⁺(aq) │ Cu(s) +
Pisteytys:
Oikeat aineet 1 p.
- Jos vääriä aineita tai varauksia, 0 p. koko osatehtävästä.
Oikeat olomuodot, 1 p.
Faasirajat ja suolasilta, 1 p.
Oikea järjestys, 1 p.
7.2 Mitä muutoksia voidaan havaita kuvan puolikennoissa elektrodireaktioiden edetessä? Perustele nämä havainnot reaktioyhtälöiden avulla. 5 p.
Sinkkielektrodi syöpyy / elektrodin massa pienenee, koska sinkki hapettuu reaktiossa:
Zn → Zn²⁺ + 2e⁻.
(2 p.)
Puhdasta kuparia muodostuu kuparielektrodin pinnalle / kuparielektrodin massa kasvaa ja kupariliuoksen sininen väri vaalenee, koska kupari-ioneja pelkistyy reaktiossa:
Cu²⁺ + 2e⁻ → Cu.
(3 p.)
7.3 Mikä on suolasillan tehtävä aineiston sähkökemiallisessa parissa? Mitä suolasillassa tapahtuu, kun sähkökemiallisesta parista otetaan energiaa? 4 p.
Suolasilta kytkee elektrodit suljetuksi virtapiiriksi. (1 p.)
Suolasillan avulla varaustasapaino/ionitasapaino säilyy liuoksissa. (1 p.)
Suolasillan kationit liikkuvat suolasiltaa pitkin kohti kuparipuolikennoa ja suolasillan anionit kohti sinkkipuolikennoa. (2 p.)
- Suolasilta mahdollistaa ionien liikkeen, mutta ei kohdistusta oikeisiin ioneihin, 1 p.
7.4 Miten tässä kokeessa tarvittava suolasilta voitaisiin valmistaa? 2 p.
Suolasilta voi olla esimerkiksi liuoksella tai geelillä täytetty putki, huokoinen kalvo tai pala kostutettua suodatinpaperia.
Suolasilta sisältää jotakin liuennutta suolaa.
Pisteytys:
Tekninen toteutus, 1 p.
Kyky välittää ioneja, 1 p.
8. Hiilen käyttö energiantuotannossa 15 p.
8.1 Perustele, miksi monissa maissa kivihiilen käyttöä energiantuotannossa on pyritty viime vuosina vähentämään. 5 p.
Hiilivoima tuottaa merkittävästi hiilidioksidipäästöjä (1 p.) ja ilmakehään kertyvä CO₂ voimistaa kasvihuoneilmiötä ja ilmastonmuutosta. (1 p.)
- Kasvihuoneilmiö/ilmastonmuutos pitää olla olla kohdistettu hiilidioksidiin.
Seuraavasta valikoimasta 1 p. tai 2 p./kohta (1 p./maininta + 1 p., jos haittavaikutuksia kuvattu), maks. 3 p.:
- Jos palaminen jää vaillinaiseksi, syntyy myös hiilimonoksidia eli häkää. Hiilimonoksidi on myrkyllistä.
- Vaillinaisessa palamisessa osa hiilestä leviää nokena ympäristöön ja pienhiukkaspäästöt lisääntyvät. Näillä on haitallisia terveysvaikutuksia.
- Kivihiilen poltossa muodostuu polyaromaattisia hiilivetyjä, jotka aiheuttavat syöpää.
- Syntyy rikkidioksidipäästöjä. Rikkidioksidi reagoi herkästi veden kanssa muodostaen rikkihapoketta. Se voi ilmassa helposti hapettua rikkihapoksi H₂SO₄. Ilmakehästä happo laskeutuu maahan kuivana laskeumana tai sadeveden mukana happosateina, jotka aiheuttavat vesistöjen ja maaperän happamoitumista.
- Ilmakehään pääsee erilaisia typen oksideja. Ne reagoivat veden kanssa, jolloin syntyy muun muassa typpihapoketta ja typpihappoa. Nämä puolestaan aiheuttavat happosateita. Typen oksidit ovat ihmiselle haitallisia. Typen oksidit vahvistavat kasvihuoneilmiötä.
- Hiilidioksidi aiheuttaa valtamerien/vesistöjen happamoitumista.
- Raskasmetallit leviävät lentotuhkan mukana.
Seuraavasta valikoimasta 1 p./kohta, maks. 1 p.
- Kivihiili on uusiutumaton energianlähde / sitä on rajallinen määrä.
- Kaivostoiminnan vaikutus luontoon
- Kivihiilen kuljetuksesta aiheutuvat kustannukset ja päästöt
- Kaivostuotannon riskit liittyen työntekijöiden turvallisuuteen
8.2
Eräässä laboratoriokokeessa 24,0 g puhdasta hiiltä C(s) paloi olosuhteissa, joissa happea oli vain rajallinen määrä. Tällöin energiaa vapautui 481,2 kJ. Palamisessa tapahtuivat samanaikaisesti reaktiot (1) ja (2):
(1) C(s) + O₂(g) → CO₂(g) ; ΔH = −393,5 kJ, kun yksi mooli hiiltä palaa.
(2) 2C(s) + O₂(g) → 2CO(g) ; ΔH = −221,0 kJ, kun kaksi moolia hiiltä palaa.
Laske tuotteina muodostuneiden hiilimonoksidin ja hiilidioksidin ainemäärät.
10 p.
(2) 2C(s) + O₂(g) → 2CO(g) ; ΔH = −221,0 kJ, kun kaksi moolia hiiltä palaa.
Tapa 1:
n(C) = 24,0 g / 12,01 g/mol = 1,9983 mol
(1 p.)
n(CO₂) · ΔH₁ + n(CO) · ΔH₂ = ΔH
(2 p.)
n(CO) + n(CO₂) = 1,9983 mol
n(CO) = 1,9983 mol – n(CO₂)
(3 p.)
Kun 1 mol CO:ta muodostuu, energiaa vapautuu 110,5 kJ.
(2 p.)
- Jos stoikiometria on huomioimatta entalpia-arvossa tai se on huomioitu väärin, ei-VSE.
n(CO₂) · 393,5 kJ/mol + (1,9983 mol − n(CO₂)) · 110,5 kJ/mol = 481,2 kJ
n(CO₂) = 0,9200867 mol ≈ 0,920 mol
n(CO) = 1,9983 mol − 0,92010 mol = 1,0782 ≈ 1,08 mol
(2 p.)
Vastaus: n(CO₂) = 0,920 mol, n(CO) = 1,08 mol
Tapa 2:
m(C₁) + m(C₂) = 24 g
(2 p.)
n(C₁) · ΔH₁ + n(C₂) · ΔH₂ = ΔH
(2 p.)
Ainemäärä (voi käydä ilmi ratkaisusta), n(C) = m(C)/M(C)
(1 p.)
Merkitään m(C₁) = x, jolloin m(C₂) = 24 – x.
(1 p.)
Kun 1 mol CO:ta muodostuu, energiaa vapautuu 110,5 kJ.
(m(C₁)/12,01) · (−393,5) + (m(C₂)/12,01) · (−110,5) = −481,2
(Yksiköt on jätetty selvyyden vuoksi pois.)
(2 p.)
- Jos stoikiometria on huomioimatta entalpia-arvossa tai se on huomioitu väärin, ei-VSE.
Sijoitetaan muuttuja x edelliseen yhtälöön.
(x/12,01) · (−393,5) + ((24 – x)/12,01) · (−110,5) = −481,2
Ratkaisu:
x = 11,050 g = m(C₁), jolloin n(C) = m/M = 11,050 g / 12,01 g/mol
= 0,920 mol = n(CO₂).
(1 p.)
m(C₂) = 24 – x = 12,95 g, jolloin n(C) = m/M = 12,95 g / 12,01 g/mol
= 1,078 mol = n(CO).
(1 p.)
Vastaus: n(CO₂) = 0,920 mol, n(CO) = 1,08 mol
Osa 3: 20 pisteen tehtävät
9. Ohutlevykromatografia 20 p.
9.1 Millaisia päätelmiä aineiston kokeen perusteella voidaan tehdä tussien A, B ja C sisältämistä värillisistä yhdisteistä? 5 p.
Seuraavasta valikoimasta maks. 5 p.:
- A ei ole liikkunut TAI B ja/tai C edennyt/edenneet TAI B ja/tai C seoksia. (1 p.)
- A on pooliton / ei ole vesiliukoinen. (1 p.)
- Eteneminen on perusteltu poolisuudella/vesiliukoisuudella ainakin yhdelle väriaineelle. (2 p.)
- B:n ja C:n sininen väriaine on sama yhdiste, koska täplät ovat samalla korkeudella. (1 p.)
- B:n ja C:n keltainen väriaine ovat eri yhdisteitä, koska täplät ovat eri korkeudella (1 p.)
9.2 Opiskelija teki hypoteesin, että kaikki aineiston kokeen tussit A, B ja C sisältävät kahta värillistä yhdistettä. Testatakseen hypoteesia hänen tulee kuitenkin tehdä vielä toinen koe. Kuvaile, millaisen kokeen hän voi tehdä testatakseen hypoteesia. 4 p.
Tussin A väriaineet ovat poolittomia. (1 p.)
Kokeessa on käytettävä poolitonta liuotinta. (2 p.)
Annettu esimerkki poolittomasta liuottimesta. (1 p.)
- Ohutlevykromatografian lisäksi myös muut soveltuvat analyysimenetelmät oikein perusteltuna hyväksytään.
9.3
Retentiokerrointa Rf eli Rf -arvoa käytetään ohutlevykromatografiassa kuvaamaan tutkittavan yhdisteen kulkemaa matkaa. Retentiokerroin määritellään seuraavasti:
R_f = \frac{\mathrm{yhdisteen\ täplän\ etäisyys\ perusviivasta}}{\mathrm{ajoliuosrintaman\ etäisyys\ perusviivasta}}
Kuvaile koe, jolla tutkitaan, onko retentiokerroin riippuvainen ajoon käytetystä ajasta. Perustele vastauksesi.
5 p.
Vakioidaan koejärjestely. Vähintään kahdelle samanlaiselle kromatografialevylle pipetoidaan sama määrä näytettä samalle korkeudelle alareunasta. (1 p.)
Varioidaan aika tai matka eri levyillä. (1 p.)
Jokaiselta levyltä mitataan tutkittavan yhdisteen kulkema matka sekä ajoliuosrintaman kulkema matka. (1 p.)
Tuloksista lasketaan retentiokertoimet Rf, joita vertaillaan keskenään. (1 p.)
Jos retentiokerroin ei riipu ajoon käytetystä ajasta, laskettujen retentiokertoimien pitäisi olla samansuuruisia. (1 p.)
9.4
Opiskelija teki toisen kokeen, jossa hän tutki ohutlevykromatografialla eri fenoliyhdisteitä sisältäviä näytteitä K, L ja M. Ajoliuoksena oli heksaanin ja etyyliasetaatin seos. Kiinteänä faasina oli levyn pinnalle kiinnittynyttä silikageeliä, jonka kemiallinen rakenne on esitetty kuvassa . Kokeen tulokset on esitetty taulukossa .
Näytteet sisälsivät fenolia (hydroksibentseeni), hydrokinonia (1,4-dihydroksibentseeni) tai 2,5-dimetyylifenolia. Perustele ohutlevykromatografiakokeen tulosten avulla, mikä näytteistä sisälsi kutakin ainetta.
6 p.
Hyväksytään kaksi eri vastausmallia, jotka johtavat erilaisiin tuloksiin.
Jos todettu, että hydrokinoni muodostaa vetysidoksia kiinteän faasin kanssa:
Kiinteän faasin OH-ryhmät / poolisuus on tunnistettu. (1 p.)
Kiinteä faasi muodostaa vetysidoksia / voimakkaampia sidoksia poolisten yhdisteiden kanssa.
TAI
Pooliset yhdisteet eivät liukene poolittomaan ajoliuokseen. (1 p.)
Hydrokinoni on poolisin, koska sillä on kaksi hydroksiryhmää. (1 p.)
Näyte K on hydrokinoni. (1 p.)
- Piste on sidottu hydrokinonin poolisuuden tunnistamiseen.
2,4-dimetyylifenolin metyyliryhmät tekevät siitä vähemmän poolisen kuin fenolista. (1 p.)
Näyte L on fenoli ja näyte M on 2,4-dimetyylifenoli. (1 p.)
- Piste on sidottu 2,4-dimetyylifenolin ja fenolin poolisuuseron tunnistamiseen.
Jos hydrokinoni on tunnistettu poolittomaksi:
- Tätä pisteytystä käytetään vain, jos hydrokinoni on tunnistettu poolittomaksi. Muissa tapauksissa käytetään ensimmäistä pisteytystä.
Ajoliuos on pooliton / kiinteä faasi on poolinen. (1 p.)
Hydrokinoni on pooliton. (1 p.)
- Hydrokinonin poolittomuus pitää perustella rakenteen avulla.
Näyte M on hydrokinoni. (1 p.)
- Piste on sidottu hydrokinonin poolittomuuden tunnistamiseen.
2,4-dimetyylifenolin metyyliryhmät tekevät siitä vähemmän poolisen kuin fenolista. (1 p.)
Näyte K on fenoli. (1 p.)
Näyte L on 2,4-dimetyylifenoli. (1 p.)
- Molemmat tunnistuspisteet on sidottu 2,4-dimetyylifenolin ja fenolin poolisuuseron tunnistamiseen.
10. Van ’t Hoffin yhtälö 20 p.
10.1 Aineistossa on esitetty erään kemiallisen reaktion Van ’t Hoffin kuvaaja. Onko reaktio endoterminen vai eksoterminen? Perustele vastauksesi. 3 p.
Reaktio on eksoterminen. (1 p.)
Kuvaaja on nouseva, eli sen kulmakerroin on positiivinen. (1 p.)
Kulmakerroin on Van ’t Hoffin yhtälön mukaan −ΔH/R, eli entalpian muutoksella on eri etumerkki kuin kulmakertoimella.
Siten entalpian muutos on negatiivinen. (1 p.)
- Kulmakertoimen tarkastelun tilalla vastauksessa voi kuvata ln(K):n ja 1/T:n välistä suhdetta sekä tasapainotilan lämpötilariippuvuutta.
10.2
Ammoniakkia voidaan valmistaa seuraavan tasapainoreaktion avulla:
N₂(g) + 3H₂(g) ⇌ 2NH₃(g).
Huoneenlämpötilassa (298 K) ja tietyssä paineessa reaktion entropian muutos ΔS = −43,4 J/(K · mol) ja entalpian muutos ΔH = −45,9 kJ/mol. Johda tasapainovakion K suureyhtälö Van ’t Hoffin yhtälöstä. Mikä on ammoniakin valmistusreaktion tasapainovakion arvo huoneenlämpötilassa?
4 p.
ΔH = −45,9 kJ/mol = −45900 J/mol
ΔS = −43,4 J/K
\ln K=-\frac{\Delta H}{R}\cdot\frac{1}{T}+\frac{\Delta S}{R}
K = e−ΔH/(RT) + ΔS/R
(2 p.)
= e−(−45900 J/mol) / [(8,31451 J/(mol · K) · 298 K)] + [−43,4 J/K / 8,31451 J/(mol · K)]
= 6,00354 · 10⁵ ≈6,00 · 10⁵
(2 p.)
- Jos ln(K):n arvo on laskettu oikein, 1 p.
- Jos K:n arvo on laskettu oikein, mutta suureyhtälöä ei ole ratkaistu, 2 p. koko osatehtävästä.
10.3
Korkeassa lämpötilassa hiilidioksidi voi hajota hiilimonoksidiksi ja hapeksi tasapainoreaktion
2CO₂(g) ⇌ 2CO(g) + O₂(g)
mukaisesti. Astiaan, jonka tilavuus oli 2,00 dm³, suljettiin 0,0900 mol hiilidioksidia. Astian tilavuus ja hiilidioksidin ainemäärä tunnettiin äärimmäisen tarkasti. Tämän jälkeen astiaa lämmitettiin ja astiassa olevan hiilidioksidin konsentraatio määritettiin spektroskooppisesti eri lämpötiloissa, kun tasapaino oli saavutettu. Tulokset on esitetty taulukossa .
Piirrä reaktiota vastaava Van ’t Hoffin kuvaaja ja määritä reaktion entalpian muutos. Oletetaan, että reaktion entalpian ja entropian muutokset eivät riipu lämpötilasta. Ilmoita vastaus kolmen merkitsevän numeron tarkkuudella.
13 p.
n(CO₂)alussa = 0,0900 mol
V = 2,00 dm³
c(CO₂)alussa = n(CO₂)alussa/V = 0,0900 mol / 2,00 dm³ = 0,0450 mol/dm³
(1 p.)
Tasapainotarkastelu:
| 2CO₂(g) | ⇌ | 2CO(g) | O₂(g) | |
| Alussa | c(CO₂) | 0 | 0 | |
| Tasapainossa | c(CO₂) – x | x | 0,5 ∙ x |
(2 p.)
- Jos tasapainotarkastelussa on virhe, ei-VSE, maks. 3 p. (alkukonsentraatio, K:n lauseke ja kuvaajan akselit).
Hiilidioksidin konsentraatio alussa ja tasapainotilassa tunnetaan, jolloin x voidaan ratkaista:
x = c(CO₂)alussa – c(CO₂)tasapainossa
(1 p.)
Tasapainovakio voidaan laskea:
K = [CO]²[O₂] / [CO₂]².
(1 p.)
Eri lämpötiloissa:
| T (K) | [CO₂] (mol/l) | x (mol/l) | [CO] (mol/l) | [O₂] (mol/l) | K | ln K | 1/T (1/K) |
| 1395 | 0,0449935 | 0,0000065 | 0,0000065 | 0,00000325 | 6,7828235 ∙ 10⁻¹⁴ | –30,3217978 | 0,0007168 |
| 1443 | 0,0449888 | 0,0000112 | 0,0000112 | 0,00000560 | 3,4706854 ∙ 10⁻¹³ | –28,6892541 | 0,0006930 |
| 1498 | 0,0449788 | 0,0000212 | 0,0000212 | 0,0000106 | 2,3548425 ∙ 10⁻¹² | –26,7745473 | 0,0006676 |
(2 p.)
- Jos taulukossa väärät ln(K):n tai 1/T:n arvot, ei-VSE, maks. 6 p.
Piirretään Van ’t Hoffin kuvaaja sovittamalla havaintopisteisiin suora.
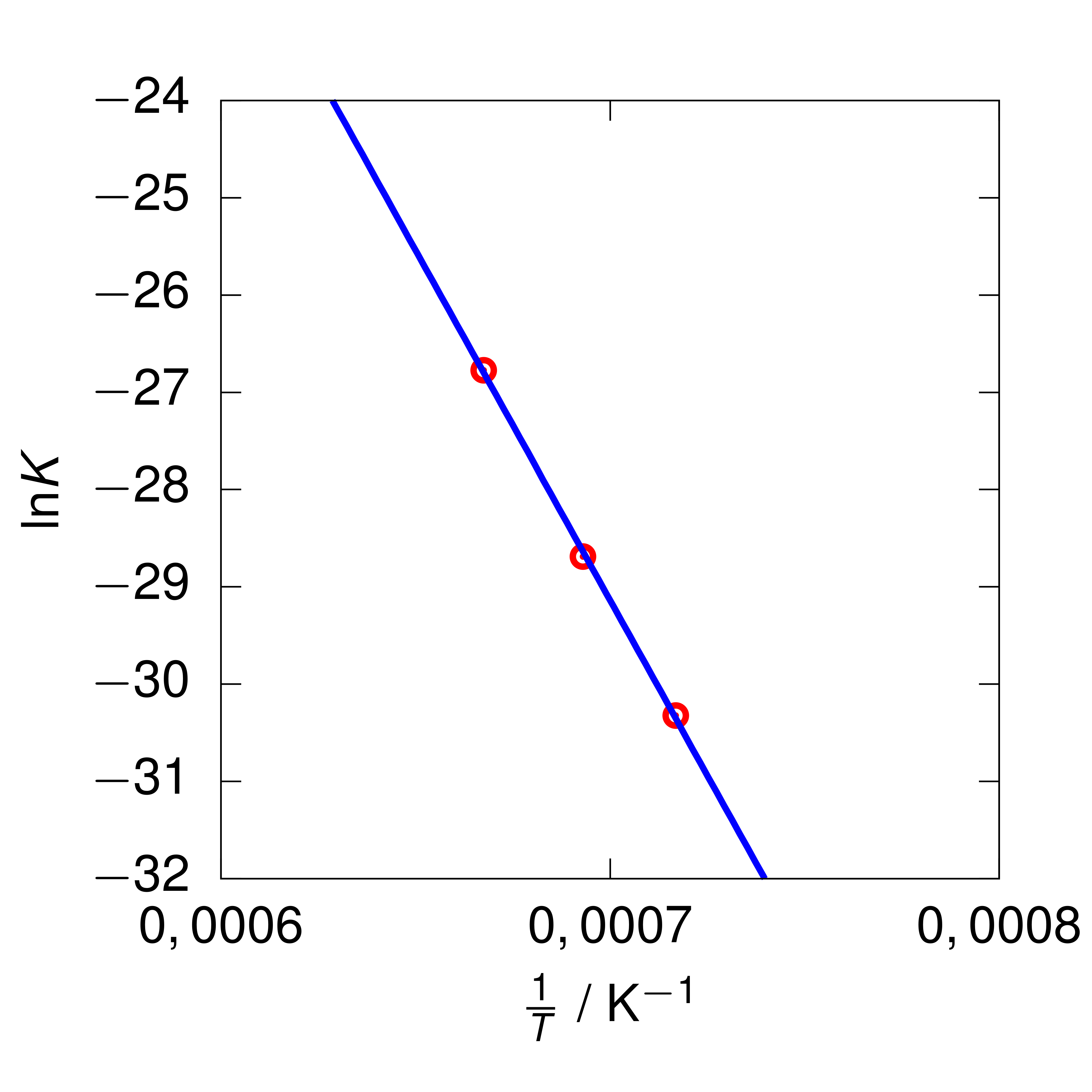 Kuva: Van ’t Hoffin kuvaaja
Kuva: Van ’t Hoffin kuvaaja
Kuvaajan pisteytys:
Oikeat akselit oikein päin ja oikeat yksiköt merkitty, 1 p.
Sijoitettu oikeat arvot, 1 p.
Suora sovitettu oikeisiin pisteisiin, 1 p.
- Jos pisteet eivät muodosta selkeää suoraa, ei-VSE.
Suoran kulmakerroin on –72004,8465 K. Van ’t Hoffin yhtälön mukaan kulmakerroin on
−ΔH/R = –72004,8465 K,
(1 p.)
- Jos suora on piirretty käyttäen liian paljon pyöristettyjä välituloksia, mikä johtaa virheeseen lopputuloksessa, –1 p.
josta voidaan ratkaista:
∆H = –(–72004,8465 K) · R
= 72004,8465 K · 8,31451 J/(mol · K)
= 598685 J/mol
≈ 599 kJ/mol.
(2 p.)
11. Laktoosin kemiaa 20 p.
Maidossa on proteiinia ja hiilihydraatteja, kuten laktoosia. Laktoosi pilkkoutuu ruoansulatuksessa laktaasientsyymin avulla kahdeksi pienemmäksi hiilihydraatiksi. Tällöin laktaasi katkaisee hydrolyyttisesti laktoosin glykosidisidoksen.
Imeväisiän jälkeen laktoosin pilkkomiskyky heikkenee isolla osalla ihmisistä. Jos elimistössä ei ole riittävästi laktaasia, maitotuotteet voivat aiheuttaa erilaisia oireita, kuten ilmavaivoja. Tästä syystä meijeriteollisuus on kehittänyt laktoosittomia maitotuotteita, joita voivat käyttää myös ne, joilla laktaasientsyymiä ei luontaisesti enää ole. Laktoositonta maitoa voidaan tuottaa käsittelemällä maitoa laktaasilla tai erottamalla laktoosi maidosta kromatografisesti.
Laktoosin rakenne on esitetty kahdessa eri konformaatiossa (I ja II) kuvassa ja aineiston videoissa.
11.1 Mihin hiilihydraattien luokkaan laktoosi kuuluu rakenteensa perusteella? 2 p.
Laktoosi kuuluu disakkarideihin. (2 p.)
11.2 Merkitse kuvan konformaatioon I glykosidisidos nuolella, ja ympyröi primääriset hydroksiryhmät (hydroksyyliryhmät). 4 p.
Pisteytys:
Nuoli glykosidisidokseen, 2 p.
Primääriset hydroksiryhmät, 1 p./ryhmä
- Väärä vastaus kumoaa oikean.
- Jos hydroksiryhmä on osoitettu tavalla, joka ei selkeästi kohdista sekä happi- että vetyatomia (esim. nuoli happiatomia kohti), –1 p. kertavähennys.
- Jos ympyröity myös muita atomeja kuin hydroksiryhmä, –1 p. kertavähennys.
11.3 Mitkä ovat laktoosin glykosidisidoksen hydrolyysissä muodostuvien hiilihydraattien triviaalinimet? 4 p.
galaktoosi (2 p.)
glukoosi (2 p.)
11.4 Laktoosittoman maidon tuotannossa käytettiin epäpuhdasta laktaasivalmistetta, mikä johti siihen, että maito alkoi maistua säilytyksen jälkeen oudolta. Ilmeni, että maito sisälsi epätavallisen suuria määriä valiinia, tryptofaania, leusiinia ja muita vastaavia yhdisteitä. Mistä nämä yhdisteet olivat peräisin? Miten ne olivat muodostuneet maitoon? 4 p.
Maidon proteiini (kaseiini) (1 p.) oli hydrolysoitunut/pilkkoutunut (2 p.), jolloin syntyi aminohappoja (1 p.).
11.5 Kuvassa ja aineiston videoilla esitetään laktoosimolekyyli kahdessa eri konformaatiossa, I ja II. Perustele, kumpi konformaatioista on energeettisesti edullisempi. Esitä tekijöitä, jotka vaikuttavat konformaatioiden energiaan. 6 p.
Seuraavasta valikoimasta 1 p. tai 2 p./kohta (1 p./havainto, 1 p./energiavertailu):
- Havainto: Konformaatiossa I havaitaan tuolikonformaatio ja konformaatiossa II havaitaan venekonformaatio. Vertailu: Tuolikonformaatio on energeettisesti edullisempi kuin venekonformaatio.
- Havainto: Konformaatiossa I saman renkaan atomit/atomiryhmät ovat kaukana toisistaan ja konformaatiossa II lähellä toisiaan. Vertailu: Lähellä toisiaan olevat ryhmät hylkivät toisiaan, mikä nostaa konformaation II energiaa.
- Havainto: Konformaatiossa I eri renkaiden atomiryhmät ovat sopivalla etäisyydellä/kaukana toisistaan ja konformaatiossa II lähellä toisiaan. Vertailu: Lähellä toisiaan olevat ryhmät hylkivät toisiaan, mikä nostaa konformaation II energiaa.
- Havainto: Konformaatiossa I voi muodostua molekyylinsisäinen vetysidos TAI konformaatiossa II sitä ei voi muodostua. Vertailu: Vetysidoksen muodostuminen laskee konformaation I energiaa.
Päätelmä: I on energeettisesti edullisempi kuin II. (2 p.)
- Piste edellyttää, että jokin energiavertailupisteistä on saatu.


