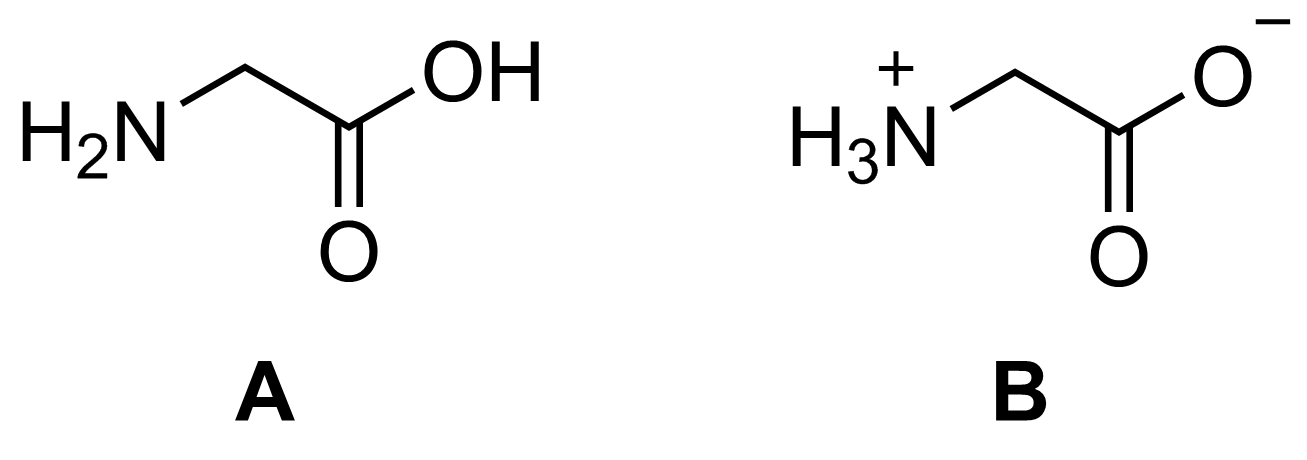Hyvän vastauksen piirteet: FI – Kemia
29.3.2023
Lopulliset hyvän vastauksen piirteet 16.5.2023
Lopullisista hyvän vastauksen piirteistä ilmenevät perusteet, joiden mukaan koesuorituksen lopullinen arvostelu on suoritettu. Tieto siitä, miten arvosteluperusteita on sovellettu kokelaan koesuoritukseen, muodostuu kokelaan koesuorituksestaan saamista pisteistä, lopullisista hyvän vastauksen piirteistä ja lautakunnan määräyksissä ja ohjeissa annetuista arvostelua koskevista määräyksistä. Lopulliset hyvän vastauksen piirteet eivät välttämättä sisällä ja kuvaa tehtävien kaikkia hyväksyttyjä vastausvaihtoehtoja tai hyväksytyn vastauksen kaikkia hyväksyttyjä yksityiskohtia. Koesuorituksessa mahdollisesti olevat arvostelumerkinnät katsotaan muistiinpanoluonteisiksi, eivätkä ne tai niiden puuttuminen näin ollen suoraan kerro arvosteluperusteiden soveltamisesta koesuoritukseen.
Ylioppilastutkinnon kokeessa selvitetään, ovatko opiskelijat omaksuneet lukion opetussuunnitelman mukaiset tiedot ja taidot sekä saavuttaneet lukiokoulutuksen tavoitteiden mukaisen riittävän kypsyyden. Kemian kokeessa arvioinnin kohteina ovat kemiallisen tiedon ymmärtäminen ja soveltaminen. Arvioinnissa otetaan huomioon myös kokeellisen tiedonhankinnan ja ‐käsittelyn taidot. Näihin kuuluvat esimerkiksi kokeiden suunnittelu, työvälineiden ja reagenssien turvallinen käyttö, tulosten esittäminen ja tulkitseminen sekä johtopäätösten tekeminen ja soveltaminen.
Kemian tehtäviä arvosteltaessa painotetaan oppiaineen luonteen mukaista esitystapaa sekä käsitteiden ja kielenkäytön täsmällisyyttä. Reaktioyhtälöt esitetään ilman hapetuslukuja pienimmin mahdollisin kokonaislukukertoimin ja olomuodoilla varustettuna. Orgaanisissa reaktioyhtälöissä käytetään rakennekaavoja, mutta olomuotoja ei tarvitse mainita. Rakennekaavojen eri esitystavat hyväksytään.
Laskennallisissa tehtävissä suureyhtälöjä ja kaavoja käytetään tavalla, joka osoittaa kokelaan ymmärtäneen tehtävänannon oikein ja soveltaneen ratkaisussaan asianmukaista periaatetta tai lakia. Vastauksesta ilmenee yksiselitteisesti, miten lopputulokseen päädytään, mutta laajoja välivaiheita ei tarvita. CAS-ohjelmia voi hyödyntää tehtävän eri vaiheissa. Merkintätapojen kannalta keskeisiä vaiheita ovat periaatteiden ja lakien sekä lopputuloksen ja johtopäätösten esittäminen. Lopputulokset annetaan lähtöarvojen mukaisella tarkkuudella yksiköineen ja johtopäätökset perustellaan.
Mittaustuloksia ja niistä piirrettyjä kuvaajia hyödynnetään tiedon analysoinnissa ja johtopäätösten tekemisessä. Mittauspisteisiin sovitetaan asianmukainen suora. Mittauspisteiden välisiä arvoja voi interpoloida kuvaajaa silmämääräisesti lukemalla tai sopivalla ohjelmalla. Kuvaajaan merkitään akselien nimet, yksiköt ja asteikko. Kuvaajaan merkitään johtopäätösten kannalta olennaiset kohdat, kuten titrauskäyrän ekvivalenttikohta tai hetkellistä nopeutta laskettaessa kyseinen tangentti.
Essee‐ ja selittävissä vastauksissa tekstiä täydennetään reaktioyhtälöillä, kaavoilla tai piirroksilla. Käsiteltäviä ilmiöitä kuvataan makroskooppisella, mikroskooppisella ja symbolisella tasolla. Vastauksesta ilmenee, että tehtävään liittyvää aineistoa on hyödynnetty, sovellettu, analysoitu ja arvioitu tehtävänannon mukaisesti. Hyvä vastaus on jäsennelty ja sisällöltään johdonmukainen.
Vastaus arvostellaan tehtäväkohtaisten kriteerien mukaisesti. Lähtökohtana ovat vastauksen ansiot, joista kertyy pisteitä. Jos keskeinen kemiallinen periaate puuttuu tai se on virheellinen, pisteiden kertyminen päättyy. Tällöin virheellisen tuloksen siirtymistä eteenpäin ei hyväksytä (ei-VSE). Tällaiset virheet ovat esimerkiksi stoikiometriavirheet, väärä rajoittava tekijä tai väärä aine reaktioyhtälössä. Muiden puutteiden tai virheiden tapauksessa virheellisen tuloksen siirtyminen eteenpäin hyväksytään (VSE), jolloin pisteiden kertyminen jatkuu puutteen tai virheen jälkeen. Kokeen osan 3 vaativat tehtävät edellyttävät täsmällisempää periaatteiden hallintaa kuin kokeen alkupään perustehtävät. Kemian kannalta epätäsmällisestä kielenkäytöstä, pienestä laskuvirheestä tai likiarvojen huolimattomasta käytöstä vähennetään 0–3 p. esimerkiksi seuraavasti:
- pyöristys- ja kopiointivirheet, jotka eivät vaikuta lopputulokseen, −0 p.
- kopiontivirheet, pyöristysvirheet ja pienet huolimattomuusvirheet, jotka vaikuttavat lopputulokseen, yksittäinen pieni virhe rakennekaavassa −1 p.
- yksikönmuunnosvirheet, systemaattinen virhe rakennekaavassa tai muut vähäistä suuremmat virheet, jossa ei kuitenkaan ole väärä kemiallinen periaate −2 p.
Korjattu osatehtävän 1.5 vastaus 30.3.2023.
Osa 1: 20 pisteen tehtävä
1. Monivalintatehtäviä kemian eri osa-alueilta 20 p.
1.1 Mikä väline ei sovellu käytettäväksi, kun tehtävänä on valmistaa pitoisuudeltaan mahdollisimman tarkkoja liuoksia? 2 p.
- erotussuppilo (2 p.)
1.2 Magnesiumjodidia MgI₂ voidaan valmistaa neutraloimalla magnesiumoksidia MgO vetyjodidilla HI. Reaktiossa muodostuu lisäksi vettä. Kuinka monta moolia magnesiumjodidia voidaan enintään valmistaa 2 moolista magnesiumoksidia ja 2 moolista vetyjodidia? 2 p.
- 1 mol (2 p.)
1.3 Mitä yhteistä on ionilla ^{23}_{11}\mathrm{Na}^+ ja atomilla ^{23}_{11}\mathrm{Na}? 2 p.
- sama määrä protoneja (2 p.)
1.4 Mikä seuraavista sidoksista on poolisin? 2 p.
- O–H (2 p.)
1.5 Bariumhydroksidin Ba(OH)₂ vesiliuos, jonka konsentraatio on 0,100 mol/dm³, titrataan vetykloridihapolla HCl, jonka konsentraatio on 0,100 mol/dm³. Ekvivalenttipisteessä on muodostunut bariumkloridin BaCl₂ vesiliuos. Mikä on sen konsentraatio? 2 p.
- 0,0333 mol/dm³ (2 p.)
1.6 Minkä suolan vesiliuos on hapan? 2 p.
- ammoniumkloridi (2 p.)
1.7
Oksaalihapon hajoamisreaktio on
(COOH)₂ (g) → CO₂ (g) + HCOOH (g)
Mikä on reaktion reaktioentalpia alla taulukoitujen muodostumisentalpioiden perusteella?
2 p.
(COOH)₂ (g) → CO₂ (g) + HCOOH (g)
| Muodostumisentalpia (kJ/mol) | |
| (COOH)₂ (g) | –731,6 |
| HCOOH (g) | –378,6 |
| CO₂ (g) | –393,5 |
- –40,5 kJ/mol (2 p.)
1.8 Infrapuna- eli IR-spektroskopian käyttö molekyylien rakenteiden selvittämisessä perustuu infrapunasäteilyn 2 p.
- aiheuttamiin molekyylien sidosvärähtelyihin. (2 p.)
1.9 Mikä seuraavista metalleista muodostaa helpoiten ioneja, joiden varaus on +3? 2 p.
- indium In (2 p.)
1.10 Mikä seuraavista yhdisteistä on hiilihydraatti? 2 p.
- tärkkelys (2 p.)
Osa 2: 15 pisteen tehtävät
2. Kemialliset sidokset 15 p.
2.1 Täydennä aukot puuttuvilla sanoilla. 4 p.
2.1.1 1 p.
2.1.2 1 p.
2.1.3 1 p.
- ei hyväksytä kloori-ionien
2.1.4 1 p.
2.2 Täydennä aukot puuttuvilla sanoilla. 5 p.
2.2.1 1 p.
2.2.2 1 p.
2.2.3 1 p.
- jos 2.2.2 vastattu vetysidoksia hyväksytään myös heikot sidokset / molekyylien väliset sidokset
2.2.4 1 p.
2.2.5 1 p.
2.3 Täydennä aukot puuttuvilla sanoilla. 2 p.
2.3.1 1 p.
2.3.2 1 p.
2.4 Täydennä aukot puuttuvilla sanoilla. 2 p.
2.4.1 1 p.
2.4.2 1 p.
2.5 Täydennä aukot puuttuvilla sanoilla. 2 p.
2.5.1 1 p.
2.5.2 1 p.
3. Liuosten valmistus ja happamuus 15 p.
3.1 Opiskelija valmisti kaliumhydroksidiliuoksen liuottamalla 2,50 g kiinteää kaliumhydroksidia KOH veteen 500 millilitran mittapullossa 25 celsiusasteen lämpötilassa. Mikä oli opiskelijan valmistaman liuoksen pH kahden desimaalin tarkkuudella? 7 p.
M(KOH) = 56,108 g/mol
(1 p.)
- hyväksytään arvot välillä 56,05 ja 56,14999 g/mol
n(KOH) = m(KOH) / M(KOH) = 2,50 g / 56,108 g/mol = 0,04455693 mol
(1 p.)
c(KOH) = n(KOH) / V(KOH) = 0,04455693 mol / 0,5 l = 0,08911385 mol/l
(1 p.)
Liukenemisessa yhdestä moolista kaliumhydroksidia muodostuu yksi mooli hydroksidi-ioneja.
(2 p.)
- Tämän voi perustella sanallisesti tai reaktioyhtälön avulla tai toteamalla n(OH⁻) = n(KOH).
- Perustelu virheellisellä reaktioyhtälöllä, tästä osuudesta 0 p.
- Jos stoikiometrinen suhde on väärin, 0 p. ja ei-VSE (pisteiden kertyminen päättyy).
Tapa 1.
pOH = −log₁₀([OH⁻]) = −log₁₀(0,08911385) = 1,050055
(1 p.)
pH = pKw − pOH = 14,00 − 1,050055 = 12,949945
(1 p.)
pH = 12,95
(1 p.)
- vastaus on annettava kahden desimaalin tarkkuudella tehtävänannon mukaisesti.
Tapa 2.
Kw = [H₃O⁺] [OH⁻]
Kw = 1,008∙10⁻¹⁴ mol² l⁻²
[H₃O⁺] = Kw / [OH⁻] =
(1 p.)
= 1,008 ∙10⁻¹⁴ mol² l⁻² / 0,08911385 mol/l = 1,1311 ∙ 10⁻¹³ mol/l
(1 p.)
pH = −log₁₀[H₃O⁺] = −log₁₀(1,1311 ∙ 10⁻¹³) = 12,95
(1 p.)
- vastaus on annettava kahden desimaalin tarkkuudella tehtävänannon mukaisesti.
3.2 Opiskelija laimensi 10,00 ml osatehtävässä 3.1 valmistamaansa kaliumhydroksidiliuosta 1,00 litraksi. Kuinka paljon kaliumhydroksidiliuoksen hydroksidi-ionikonsentraatio muuttui? Mikä oli uuden liuoksen pH kahden desimaalin tarkkuudella? Perustele vastauksesi sanallisesti tai laskemalla. 5 p.
Tapa 1.
Kaliumhydroksidiliuos ja hydroksidi-ionikonsentraatio laimenevat sadasosaan alkuperäisestä.
(2 p.)
Koska pH-asteikko on logaritminen, liuoksen pH-arvo muuttuu kahden pH-yksikön verran.
(2 p.)
Uuden liuoksen pH on tällöin 10,95.
(1 p.)
Tapa 2.
Lasketaan laimennetulle liuokselle c(KOH) = [OH⁻]:
c₁ ∙ V₁ = c₂ ∙ V₂.
c₂ = c₁ ∙ V₁ / V₂
c₂ = 0,08911385 mol/l ∙ 10 ml / (1000 ml)
= 0,0008911385 mol/l = 8,911385 ∙ 10⁻⁴ mol/l
(1 p.)
Konsentraatio pieneni 0,0882 mol/l (0,09 mol/l) tai 99 %
tai
uusi konsentraatio on 0,01-kertainen verrattuna alkuperäiseen
(1 p.)
pOH = −log₁₀[OH⁻] = −log₁₀(8,911385∙10⁻⁴) = 3,05005478
(1 p.)
pH = pKw − pOH = 14,00 − 3,05005478 = 10,94994522
(1 p.)
pH = 10,95
(1 p.)
- Jos osatehtävässä 3.1 konsentraatio on väärin, siten, että osatehtävässä 3.2 saadaan pH < 7 tai pH > 15, korkeintaan 2 p. osatehtävästä 3.2 (laimennoksen pisteet)
3.3 Mitä suojavälineitä opiskelijan pitää käyttää valmistaessaan osatehtävien 3.1 ja 3.2 liuoksia? Miksi näitä suojavälineitä tarvitaan? 3 p.
Normaali laboratorion suojavarustus: suojalasit ja laboratoriotakki / suojakäsineet.
(1 p.)
Kaliumhydroksidi on vahva emäs
(1 p.)
ja voimakkaasti syövyttävää.
Tai
vaurioittaa ihoa/silmiä/vaatteita.
Tai
Liukenemisen yhteydessä liuos kuumenee voimakkaasti.
(1 p.)
4. Aminohappojen rakenteet 15 p.
4.1 Nimeä ne glysiinin ja proliinin funktionaaliset ryhmät, joissa on typpiatomi. Luokittele nämä funktionaaliset ryhmät käyttämällä termejä primäärinen, sekundäärinen tai tertiäärinen. 4 p.
Glysiinissä on aminoryhmä (1 p.), joka on primäärinen (1 p.).
Proliinissa on aminoryhmä (1 p.), joka on sekundäärinen (1 p.).
- Primäärinen/sekundäärinen on kohdistettava aminoryhmään ja oikeaan yhdisteeseen.
- Jos aminoryhmän tilalla on amiini/amiiniryhmä, 0 p. funktionaalisesta ryhmästä mutta pisteet voi saada primäärinen/sekundäärinen -luokituksesta.
4.2 Esitä rakenne tuotteelle, joka syntyy, kun asparagiinihappo liukenee natriumhydroksidin vesiliuokseen. Natriumhydroksidia on ylimäärin. 4 p.
Vastauksena hyväksytään esimerkiksi alla olevien kuvien mukaiset rakenteet (olomuotomerkintöjä ei edellytetä).
 Kuva: Asparagiinihapon natriumsuolan rakenne esitettynä kahdella eri tavalla.
Kuva: Asparagiinihapon natriumsuolan rakenne esitettynä kahdella eri tavalla.
(4 p.)
- Pisteitys: 2 p. / oikein neutraloitu -COOH -ryhmä.
- ylimääräinen tuote tai virheitä varauksissa, −2 p./virhe
4.3
Tarkastele alla olevassa taulukossa esitettyjä glysiinin ominaisuuksia sekä kahta kuvassa esitettyä glysiinin rakennetta A ja B.
Sulamispiste Liukoisuus veteen Liukoisuus dietyylieetteriin 233 °C 22 g / 100 ml alle 0,1 g / 100 ml
Mitä sidoksia rakenne A muodostaisi kiinteässä olomuodossa? Mitä sidoksia se muodostaisi liuetessaan veteen?
Mitä sidoksia rakenne B muodostaisi kiinteässä olomuodossa? Mitä sidoksia se muodostaisi liuetessaan veteen?
Perustele, miksi kahtaisionimuoto B vastaa paremmin glysiinin suhteellisen korkeaa sulamispistettä ja liukoisuuksia.
7 p.
| Sulamispiste | Liukoisuus veteen | Liukoisuus dietyylieetteriin |
| 233 °C | 22 g / 100 ml | alle 0,1 g / 100 ml |
Rakenne A muodostaa kiinteässä olomuodossa vetysidoksia ja dipoli-dipolisidoksia.
(1 p.)
Rakenne A muodostaa veteen liuetessaan vesimolekyylien kanssa vetysidoksia.
(1 p.)
Rakenne B muodostaa kiinteässä olomuodossa ionisidoksia.
(1 p.)
Rakenne B muodostaa veteen liuetessaan vesimolekyylien kanssa ioni-dipolisidoksia.
(1 p.)
Seuraavista korkeintaan 3 p.:
Suhteellisen korkea sulamispiste viittaa siihen, että kidehilassa on ionisidoksia eli kyseessä on kahtaisionimuoto B. B:n muodostamat ionisidokset ovat vahvempia kuin A:n muodostamat vetysidokset, ja siksi B:llä on korkeampi sulamispiste.
(2 p.)
- vertailussa pitää olla oikeat sidokset
B on niukkaliukoinen eetteriin, mutta liukenee hyvin veteen.
(1 p.)
Ioni-dipolisidokset B:n ja veden välillä vahvempia veden kanssa kuin vetysidokset A:n ja veden välillä.
(2 p.)
Niinpä kahtaisionimuoto B vastaa paremmin glysiinin ominaisuuksia.
5. Polymeerit 15 p.
Polyhydroksialkanoaatit ovat bakteerien tuottamia suoraketjuisia polymeerejä. Niistä valmistetut muovit ovat biohajoavia.
Tavallisimpia polyhydroksialkanoaatteja ovat poly-3-hydroksibutanaatti (P3HB) ja polyhydroksivaleraatti (PHV):
5.1 Voiko P3HB:n tai PHV:n toistuvilla yksiköillä esiintyä konformaatioisomeriaa, cis-trans-isomeriaa tai enantiomeriaa (peilikuvaisomeriaa/optista isomeriaa)? Perustele vastauksesi toistuvien yksiköiden rakenteiden avulla. 7 p.
Havainnot ja perustelut on kohdistettava kumpaankin yhdisteeseen, muuten 0 p./kohta.
Toistuvilla yksiköillä voi esiintyä konformaatioisomeriaa,
(1 p.)
koska niissä on yksinkertaisia C–C-sidoksia, jotka voivat kiertyä sidosakselin ympäri.
(1 p.)
Toistuvilla yksiköillä ei voi esiintyä cis-trans-isomeriaa,
(1 p.)
koska niissä ei ole C=C-kaksoissidosta / syklistä rakennetta.
(1 p.)
Toistuvilla yksiköillä voi esiintyä enantiomeriaa,
(1 p.)
koska niissä on asymmetrinen hiiliatomi/kiraliakeskus.
(1 p.)
Kokelas on osoittanut kiraliakeskuksen paikan kummassakin toistuvassa yksikössä.
(1 p.)
5.2 Mitkä funktionaaliset ryhmät syntyvät niissä polymerointireaktioissa, joissa P3HB ja PHV muodostuvat? 3 p.
Kumpaankin syntyy esteri/esteriryhmä.
Tai:
Polymeeriketjun toiseen päähän muodostuu karboksyyliryhmä ja toiseen päähän hydroksiryhmä.
(3 p.)
- Väärät ylimääräiset ryhmät −1 p./ryhmä.
5.3 Bakteerit valmistavat polyhydroksialkanoaatteja karboksyylihapoista. Piirrä sen yhdisteen rakennekaava, josta PHV on muodostunut. 4 p.
3-etyyli-3-hydroksipentaanihapon rakennekaava:
 Kuva esittää 3-etyyli-3-hydroksipentaanihapon rakennekaava.
Kuva esittää 3-etyyli-3-hydroksipentaanihapon rakennekaava.
(4 p.)
- väärät tai puuttuvat funktionaaliset ryhmät, 0 p.
5.4 P3HB:n valmistusreaktio on polymerointireaktio. Mihin muuhun reaktiotyyppiin tämä reaktio voidaan luokitella? 1 p.
Kondensaatio-, polykondensaatio-, esteröinti- tai substituutioreaktioksi.
(1 p.)
6. Ydinvoimalaonnettomuuden kemiaa 15 p.
6.1 Fukushiman ydinreaktoreiden sisällä oli ydinpolttoaineen lisäksi paineistettua vettä. Tämä vesi oli täysin suljetussa tilassa. Reaktorin normaalin toiminnan aikana paine oli 7 000,0 kPa ja lämpötila 315 °C. Onnettomuudesta aiheutuneen häiriön aikana ydinpolttoaineen lämpötila nousi 2 800 celsiusasteeseen. Oletetaan, että vesi oli koko ajan kaasumaista ja käyttäytyi ideaalikaasun tavoin. Laske vesihöyryn paine reaktorissa lämpötilassa 2 800 °C. 5 p.
T₁ = (315 + 273,15) K = 588,15 K
T₂ = (2 800 + 273,15) K = 3 073,15 K
(1 p.)
p₁ = 7 000,0 kPa
Veden lämpötilan noustessa tilavuus, ainemäärä ja kaasuvakio pysyvät muuttumattomina. Muokataan ideaalikaasun tilanyhtälöä siten, että paine ja lämpötila ovat yhtälön toisella puolella ja loput suureet sekä kaasuvakio ovat toisella puolella.
pV = nRT
p / T = nR / V
Koska kaikki suureet yhtälön oikealla puolella ovat vakioita, voidaan merkitä:
p₁ / T₁ = nR / V
p₂ / T₂ = nR / V
p₁/ T₁ = p₂ / T₂
(2 p.)
- Vastaavaa voi johtaa eri tavoin, mutta pisteet edellyttävät aina, että ainemäärä ja tilavuus on todettu vakioiksi.
Ratkaistaan yhtälöstä p₂:
p₂ = p₁ · T₂ / T₁
= 7 000,0 kPa · 3 073,15 K / 588,15 K
(1 p.)
= 36 575,7885 kPa ≈ 37 000 kPa
(1 p.)
- Vastaus hyväksytään yhden, kahden tai kolmen merkitsevän numeron tarkkuudella.
6.2
Ydinreaktorin polttoainesauvojen pinnoite oli valmistettu zirkoniumista Zr. Kun zirkonium lämpenee noin 900 celsiusasteen lämpötilaan, se alkaa reagoida vesihöyryn kanssa. Vesihöyry hapettaa zirkoniumia, ja reaktiotuotteena syntyy kiinteää zirkoniumin oksidia sekä vetyä. Hapettuessaan zirkonium luovuttaa kaikki 5s- ja 4d-orbitaalien elektronit.
Kirjoita reaktioyhtälö zirkoniumin reaktiolle vesihöyryn kanssa. Mikä on zirkoniumin hapetusluku reaktiotuotteessa? Vastausta ei tarvitse perustella.
5 p.
Zr (s) + 2H₂O (g) → ZrO₂ (s) + 2H₂ (g)
(4 p.)
Pisteitys:
- ZrO₂ oikein 1 p.
- Muut aineet oikein 1 p., edellyttäen, että ZrO₂ oikein
- Oikeat kertoimet, (1 p., edellyttäen, että aineet ovat oikein)
- Oikeat olomuodot (1 p., edellyttäen, että aineet ovat oikein)
Zirkoniumin hapetusluku tuotteessa on +IV tai +4.
(1 p.)
6.3 Fukushiman onnettomuudessa zirkoniumin hapettumisreaktion kaasumainen tuote vapautui reaktorirakennukseen. Tämä johti räjähdykseen. Mistä räjähdys johtui? 3 p.
Räjähdys johtuu vetykaasusta.
(1 p.)
Vetykaasu muodostaa ilman happikaasun kanssa räjähtävän / helposti syttyvän seoksen.
(1 p.)
Tämä seos voi syttyä/räjähtää kipinästä/kuumuudesta.
(1 p.)
- Pisteet edellyttävät, että räjähdyksen syy on vetykaasu. Jos vedyn lisäksi mainitaan virheellinen räjähdystä aiheuttava aine, −1 p.
6.4 Räjähdyksen jälkeen vaurioituneeseen ydinvoimalarakennukseen pumpattiin typpikaasua, jotta uusia räjähdyksiä ei enää tapahtuisi. Mihin tämä perustui? 2 p.
Pumppaamalla reaktorirakennukseen typpeä vähennetään hapen suhteellista määrää ilmassa.
Tai
Typpi syrjäyttää/korvaa happea/vetyä/(räjähtävää) kaasuseosta.
Tai
Typpi ei reagoi/on inertti kaasu.
(1 p.)
Koska happi on edellytys vetykaasun palamisreaktiolle/räjähdykselle, voidaan happea vähentämällä vähentää palamisen todennäköisyyttä.
(1 p.)
- Jos vastaus perustuu typen reaktioihin esim. vedyn tai hapen tai reaktorissa olevien aineiden kanssa, 0 p. osatehtävästä.
7. Oksaalihapon hajoaminen kaasufaasissa 15 p.
Oksaalihappo on huoneenlämpötilassa kiinteä aine. Pieni osa oksaalihaposta kuitenkin sublimoituu kaasumaiseksi. Kun oksaalihapon lämpötilaa nostetaan, oksaalihappoa alkaa höyrystyä yhä enemmän. Kun lämpötila nousee yli 100 celsiusasteeseen, kaasumainen oksaalihappo alkaa hitaasti hajota tuottaen hiilidioksidia ja muurahaishappoa (metaanihappoa):
(COOH)₂ (g) → CO₂ (g) + HCOOH (g)
Tutkija lämmitti oksaalihappoa ja sulki kaasumaisen oksaalihapponäytteen reaktoriin, jonka lämpötila oli 140 °C. Reaktorin tilavuus oli 2,00 litraa, ja ennen oksaalihapon lisäämistä reaktorissa oli tyhjiö. Tämän jälkeen hän seurasi oksaalihapon konsentraation muutosta reaktorissa ajan funktiona. Reaktionopeus oli verrannollinen oksaalihapon konsentraatioon reaktorissa. Mittaustulokset on koottu taulukkoon . Oletetaan, että kaasut käyttäytyvät ideaalikaasun tavoin.
7.1 Mikä on oksaalihapon keskimääräinen hajoamisnopeus 3 000–4 000 sekunnin aikavälillä? 3 p.
Keskimääräinen hajoamisnopeus aikavälillä Δt on Δc / Δt.
Δc / Δt =
(1 p.)
[c(C₂H₂O₄)(t = 4 000 s) − c(C₂H₂O₄)(t = 3 000 s)] / (4 000 s − 3 000 s)
= (21,8 – 24,5) · 10⁻⁶ mol/l / 1 000 s
(1 p.)
= −2,70 · 10⁻⁹ mol/(l s) = −2,70 nmol/(l s)
(1 p.)
Hyväksytään sekä positiivinen että negatiivinen tulos.
- Vastaus hyväksytään yhden, kahden tai kolmen merkitsevän numeron tarkkuudella.
- Vastaus on perusteltava joko laskennallisesti tai kuvaajan avulla (esimerkiksi kuvaajan tangentin kulmakertoimen perusteella).
- Pienet virheet yksikössä tai puuttuva kymmenpotenssi, −1 p. / virhe
7.2 Mikä on kaasuseoksen kokonaispaine, kun kaikki oksaalihappo on hajonnut? 4 p.
Reaktion lopussa kaasumaisten tuotteiden kokonaiskonsentraatio on kaksi kertaa niin suuri kuin oksaalihapon konsentraatio reaktion alussa.
c((COOH)₂, alku) = 34,9 ·10⁻⁶ mol/l
tai jos laskettu ainemäärä erikseen
n((COOH)₂, alku) = 34,9 ·10⁻⁶ mol/l · 2 l = 69,8 · 10⁻⁶ mol
(1 p.)
Karkeat virheet, josta 0 p. ja pisteiden kertyminen päättyy (mutta stoikiometriapisteen voi silti ansaita, eli osatehtävästä korkeintaan 1 p.):
- Astian tilavuus laskettu moolitilavuuden avulla NTP:ssä tai STP:ssä.
- Oksaalihapon konsentraationa käytetty konsentraatiota ajanhetkellä 5000 s.
c(g, loppu) = 2 · 34,9· 10⁻⁶ mol/l = 69,8 · 10⁻⁶ mol/l
(1 p.)
- Tämä piste tulee oikeasta stoikiometrisesta kertoimesta. Jos väärä kerroin, pisteiden kertyminen päättyy ja osatehtävästä korkeintaan 1 p. alun ainemäärästä/konsentraatiosta.
p = (n/V)·RT = c(g, loppu) · RT
= 69,8 · 10⁻⁶ mol/l · 8,3144626 l kPa / (mol K) · (273,15 + 140) K
(1 p.)
= 239,771 Pa ≈ 240 Pa
(1 p.)
- Jos lämpötilat sijoitettu Celciusasteina, 0 p. sijoituksesta ja vastauksesta.
7.3 Miten oksaalihapon hajoamisnopeus muuttuisi, jos reaktorin lämpötilaa nostettaisiin? Perustele muutos kemiallisesti. 4 p.
Oksaalihapon hajoamisnopeus kasvaa lämpötilaa nostettaessa.
(1 p.)
Lämpötilan noustessa oksaalihappomolekyylien kineettinen energia / keskimääräinen nopeus / entalpia kasvaa
(1 p.)
Selitys, korkeintaan 2 p.:
Tapa 1. Selitys törmäyksillä:
ja yhä suurempi osa oksaalihappomolekyylien välisistä törmäyksistä on reaktiivisia / tarpeeksi energeettisiä johtaakseen reaktioon / ylittääkseen aktivaatioenergian. Reaktiivisten törmäysten määrän kasvu johtaa suurempaan hajoamisnopeuteen.
(2 p.)
Tai
Tapa 2. Selitys värähtelyenergialla/kineettisellä energialla:
yhä suuremmalla osalla oksaalihappomolekyyleistä on tarpeeksi iso sisäinen kineettinen energia / entalpia jotta hajoamisreaktio voi tapahtua. Tämä johtaa suurempaan hajoamisnopeuteen.
(2 p.)
7.4 Kuvaile, miten reaktionopeus muuttuu reaktion edetessä. Muuttuisiko reaktionopeus, jos seoksesta poistettaisiin hiilidioksidia? Perustele. 4 p.
Reaktionopeus / hajoamisnopeus pienenee reaktion edetessä.
(1 p.)
Hiilidioksidin poistamisella ei ole vaikutusta reaktionopeuteen.
(1 p.)
Seuraavista maks. 2 p.:
Reaktionopeus on verrannollinen oksaalihapon konsentraatioon.
Tai
Reaktion edetessä oksaalihapon konsentraatio pienenee, joten myös reaktionopeus pienenee.
(1 p.)
Reaktionopeus riippuu vain oksaalihapon/lähtöaineen konsentraatiosta.
Tai
Hiilidioksidin määrällä ei ole merkitystä, koska kyseessä ei ole tasapainoreaktio.
(2 p.)
8. Kobolttikloridin reaktioita 15 p.
Kun kiinteää kobolttikloridia \mathrm{CoCl_2(s)} liuotetaan veteen, muodostuu heksa-akvakoboltti(II)ioni \left[\mathrm{Co(H_2O)_6}\right]^{2+}, jonka vesiliuos on väriltään punainen. Kun taas kobolttikloridi liukenee etanoliin, muodostuu sininen liuos, joka sisältää tetraklorokobaltaatti(II)ioneja \left[\mathrm{CoCl_4}\right]^{2-}. Kun nämä liuokset yhdistetään, muodostuu tasapainotila, jota voidaan kuvata seuraavan tasapainoreaktion avulla:
| \left[\mathrm{Co(H_2O)_6}\right]^{2+}\ +\ 4\mathrm{Cl}^-\ \rightleftharpoons \ \left[\mathrm{CoCl_4}\right]^{2-}\ +\ 6\mathrm{H_2O} | |
| punainen | sininen |
Tasapainotilan asema vaikuttaa liuoksen väriin. Tietyssä tasapainotilassa liuos sisältää yhtä suuret määrät punaista ja sinistä ionia ja on väriltään violetti.
8.1 Violettiin liuokseen lisätään vettä. Mitä liuoksessa tapahtuu, ja miten sen väri muuttuu? 3 p.
Liuokseen lisätään vettä, joka on reaktiotuote,
(1 p.)
jolloin reaktion tasapaino siirtyy vasemmalle.
(1 p.)
- jos tasapainon sanotaan siirtyvän vain hetkellisesti, tätä pistettä ei ansaita
Liuoksen väri muuttuu punaiseksi.
(1 p.)
8.2 Violettiin liuokseen lisätään väkevää suolahappoliuosta. Mitä liuoksessa tapahtuu, ja miten sen väri muuttuu? 3 p.
Liuokseen lisätään kloridi-ioneja/lähtöainetta,
(1 p.)
jolloin reaktion tasapaino siirtyy oikealle.
(1 p.)
- jos tasapainon sanotaan siirtyvän vain hetkellisesti, tätä pistettä ei ansaita
Liuoksen väri muuttuu siniseksi.
(1 p.)
8.3 Violettiin liuokseen lisätään väkevää rikkihappoliuosta. Mitä liuoksessa tapahtuu, ja miten sen väri muuttuu? 3 p.
Liuokseen lisätty rikkihappo sitoo vettä (H₂O),
(1 p.)
jolloin (reaktiotuotteen määrä vähenee ja) reaktion tasapaino siirtyy oikealle.
(1 p.)
- jos tasapainon sanotaan siirtyvän vain hetkellisesti, tätä pistettä ei ansaita
Liuoksen väri muuttuu siniseksi.
(1 p.)
8.4 Katso video . Siniseen liuokseen lisätään AgNO₃ (aq). Mitä liuoksessa tapahtuu, ja mitä johtopäätöksiä havaintojen perusteella voi tehdä? 3 p.
Liuoksen väri muuttuu punaiseksi/violetiksi/vaaleanpunaiseksi
Tai
Liuokseen muodostuu valkoinen sakka
- oikeiden lisäksi väärät havainnot (esim. kupliminen), ei pistettä tästä kohdasta
(1 p.)
Hopea- ja kloridi-ionit saostuvat hopeakloridiksi
(Ag⁺(aq) + Cl⁻(aq) → AgCl(s)).
(1 p.)
Tällöin kloridi-ioneja/lähtöainetta poistuu liuoksesta, jolloin reaktion tasapaino siirtyy vasemmalle.
(1 p.)
- vastauksessa on mainittava sekä lähtöaineen/kloridi-ionien väheneminen että tasapainon siirtyminen
8.5 Katso video . Violettiin liuokseen laitetaan kuumennettu lasisauva. Tällöin liuoksen väri muuttuu siniseksi. Mitä liuoksessa tapahtuu, ja mitä johtopäätöksiä havaintojen perusteella voi tehdä? 3 p.
Liuoksen lämpötila nousee, kun kuuma lasisauva laitetaan siihen.
(1 p.)
Koska liuos muuttuu siniseksi, tasapaino siirtyy oikealle.
(1 p.)
Tämän vuoksi reaktio vasemmalta oikealle on endoterminen.
(1 p.)
Osa 3: 20 pisteen tehtävät
9. Tamoksifeenin synteesi 20 p.
Tamoksifeeni on rintasyövän hoidossa käytettävä lääkeaine. Tutkija valmisti tamoksifeeniä aineistossa esitetyn synteesireitin mukaisesti.
Tutustu aineistoon ja tee tehtävät 9.1–9.4.
9.1 Lähtöaine A on kahden stereoisomeerin seos. Piirrä näiden isomeerien rakennekaavat. 5 p.
Lähtöaineen isomeerien rakennekaavat:
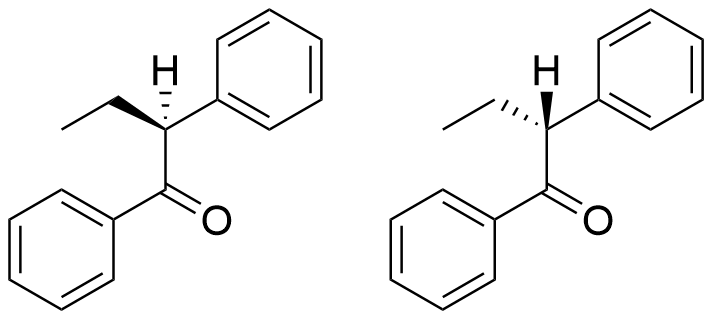 Kuva esittää lähtöaineen isomeerien rakennekaavat.
Kuva esittää lähtöaineen isomeerien rakennekaavat.
(5 p.)
- karbonyyliryhmän tilalla toinen funktionaalinen ryhmä, 0 p.
- virheitä kiraalisen hiilen sidoksissa, 0 p.
- asymmetriakeskuksen kolmiulotteisuus ei tule lainkaan ilmi, 0 p. (kuitenkin 1 p., jos kiraalinen hiili on oikein tunnistettu)
9.2 Välituote C on alkoholi, josta muodostuu eliminaatioreaktiossa tamoksifeeniä (vaihe II). Piirrä välituotteen C rakennekaava. Stereoisomeriaa ei tarvitse huomioida rakennekaavassa. 5 p.
9.3
Tutkija analysoi alkuaineanalyysin avulla vaiheessa II saadun reaktiotuotteen. Analyysin perusteella tuotteen massaprosenttinen koostumus oli seuraava:
C: 84,05 %, H: 7,87 %, N: 3,77 %, O: 4,31 %.
Osoita laskemalla, että tulos vastaa tamoksifeeniä.
5 p.
Moolimassan määritys:
M(tamoksifeeni) = 26 · M(C) + 29 · M(H) + M(N) + M(O) = 26 · 12,01 g/mol + 29 · 1,008 g/mol + 14,01 g/mol + 16,00 g/mol = 371,502 g/mol
(2 p.)
- Jos moolimassan yksikkö puuttuu kokonaan, −1 p.
- Jos molekyylikaavassa on yksi vety liian vähän tai liian paljon, tai jos moolimassa muun virheen johdosta poikkeaa korkeintaan ±1,000 g/mol, 0 p. moolimassasta mutta VSE ja korkeintaan 3 p. osatehtävästä (prosenttilaskun ja johtopäätöksen pisteet)
- Jos moolimassa poikkeaa enemmän kuin ±1,000 g/mol, 0 p. moolimassasta mutta VSE ja korkeintaan 2 p. osatehtävästä (prosenttilaskun pisteet, mutta ei johtopäätöksen pisteet)
Prosenttilasku:
m-%(C) = 26 · M(C) / M(tamoksifeeni) = 26 · 12,01 g/mol / 371,502 g/mol = 0,8405338 = 84,05338 % ≈ 84,05 %
m-%(H) = 29 · M(H) / M(tamoksifeeni) = 29 · 1,008 g/mol / 371,502 g/mol = 0,07868598 = 7,868598 % ≈ 7,87 %
m-%(N) = M(N) / M(tamoksifeeni) = 14,01 g/mol / 371,502 g/mol = 0,03771177 = 3,771177 % ≈ 3,77 %
m-%(O) = M(O) / M(tamoksifeeni) = 16,00 g/mol / 371,502 g/mol = 0,04306840 = 4,306840 % ≈ 4,31 %
- vain kaksi oikein 1 p., kaikki neljä oikein 2 p.
Johtopäätös:
Lasketut alkuainesuhteet vastaavat tamoksifeenin molekyylikaavaa C₂₆H₂₉NO.
(1 p.)
Vaihtoehtoinen ratkaisutapa:
Oletetaan tasan 100 g ainetta ja määritetään aineen empiirinen kaava/molekyylikaava.
| Alkuaine | Osuus (%) | Massa (g) | Moolimassa (g/mol) | Ainemäärä |
|---|---|---|---|---|
| C | 84,05 | 84,05 | 12,01 | 6,99833 mol |
| H | 7,87 | 7,87 | 1,008 | 7,80754 mol |
| N | 3,77 | 3,77 | 14,01 | 0,269094 mol |
| O | 4,31 | 4,31 | 16,00 | 0,269375 mol |
(2 p.)
- vain kaksi oikein 1 p., kaikki neljä oikein 2 p.
- Jos moolimassan yksikkö puuttuu kokonaan, −1 p.
n(C) : n(H) : n(N) : n(O)
6,99833 mol : 7,870754 mol : 0,269094 mol : 0,269375 mol
= 26,0071 : 29,0142 : 1 : 1,00104
≈ 26 : 29 : 1 : 1
(2 p.)
Lasketut alkuainesuhteet vastaavat tamoksifeenin molekyylikaavaa C₂₆H₂₉NO.
(1 p.)
9.4 Alkuaineanalyysin jälkeen tutkija päätti analysoida vaiheessa II saamansa tuotteen vielä nestekromatografialla ja massaspektrometrilla. Kromatografian perusteella tutkija päätteli, että vaiheessa II syntyi kahta eri tuotetta. Toinen tuotteista vastasi rakennetta D. Massaspektrin perusteella tuotteilla oli sama moolimassa. Piirrä tuntemattoman tuotteen rakennekaava. 5 p.
Tuntemattoman tuotteen rakennekaava:
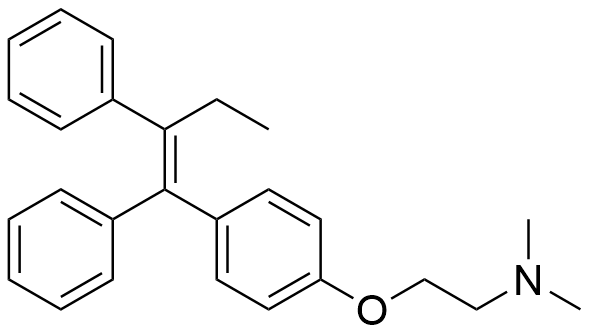 Kuva esittää tuntemattoman tuotteen rakennekaava.
Kuva esittää tuntemattoman tuotteen rakennekaava.
(5 p.)
- Kaksoissidokeen suoraan sitoutuvat ryhmät pitää olla oikein.
- Piirretty molemmat isomeerit (Z ja E) ilman tuntemattoman tuotteen spesifiointia, −2 p.
- Jos C=C-kaksoissidos on väärässä paikassa, 0 p. VSE ei hyväksytä osatehtävästä 9.2.
10. Suuveden fosfaatti-ionikonsentraatio 20 p.
Natriumfosfaattia käytetään suuveden pH-arvon säätämiseen. Suuvesinäytteen fosfaatti-ionikonsentraatio määritettiin kompleksometrisella titrauksella. Tutustu titrauksen periaatteeseen aineistossa .
Suuvesinäytteen tilavuus oli 25,00 ml. Se pipetoitiin 100 ml mittapulloon, joka täytettiin vedellä merkkiin asti. Mittapullosta otettiin osanäyte, jonka tilavuus oli 10,00 ml. Osanäytteeseen lisättiin 2,000 ml Bi(NO3)3-liuosta, jonka konsentraatio oli 0,0500 mol/l. Sen jälkeen osanäytteeseen lisättiin vielä 40 ml vettä sekä 0,1 ml PAR-indikaattoria. Osanäyte titrattiin EDTA-liuoksella, jonka konsentraatio oli 0,0150 mol/l. Titraustulokset on esitetty aineistossa .
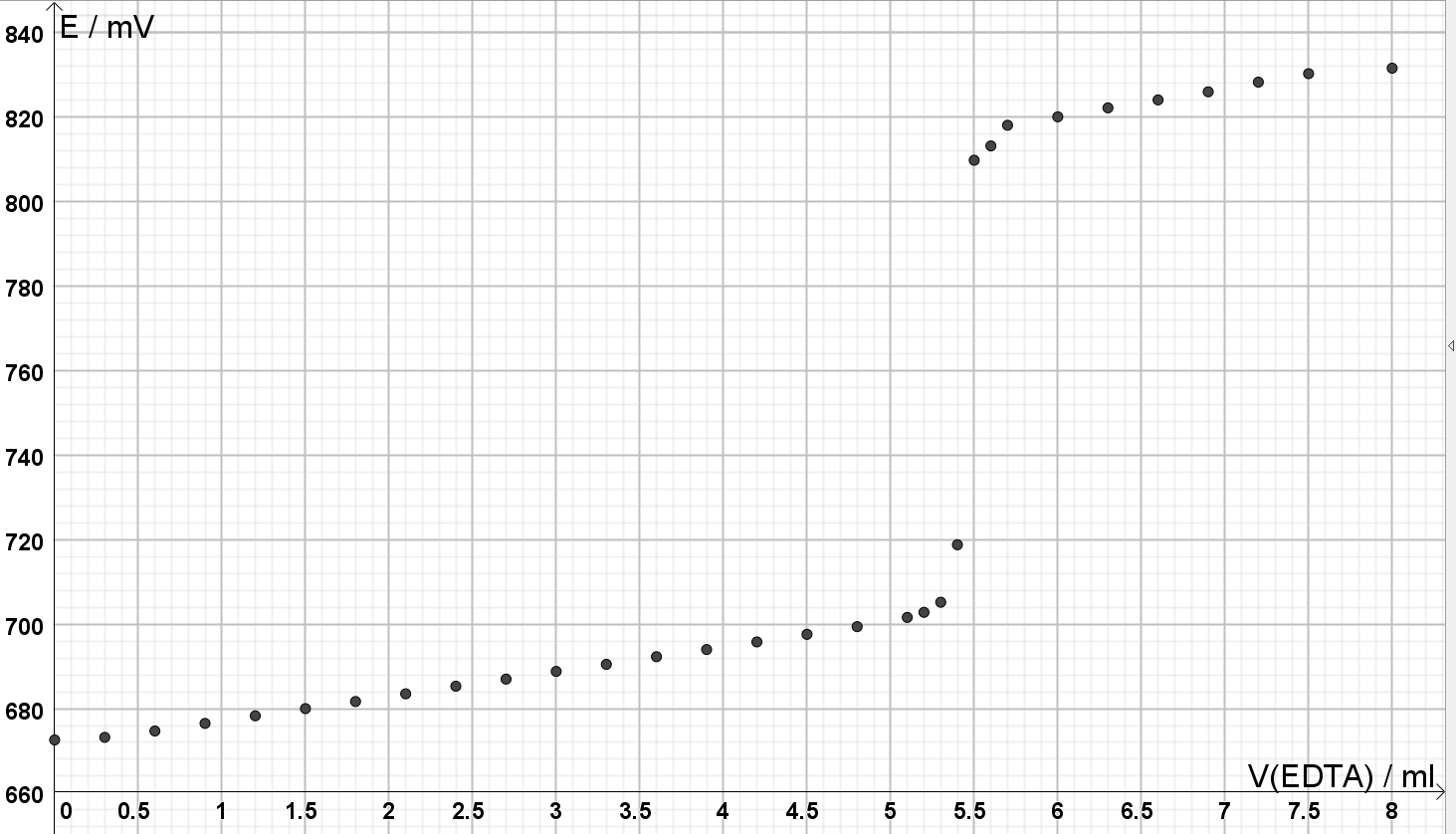
10.1 Piirrä titrauskäyrä ja määritä käyrältä EDTA-liuoksen kulutus ekvivalenttipisteessä. 4 p.
Piirretään titrauskäyrä:
Titrauskäyrä, 2 p.:
- Pisteet merkitty koordinaatistoon/pisteet yhdistetty/kuvaaja piirretty, akselit oikeinpäin, 1 p.
- Akselit nimetty oikeilla suureilla ja akseleilla oikeat yksiköt, 1 p.
Ekvivalenttipisteen määritys, 2 p.:
Luetaan ekvivalenttipiste nopeasti nousevan lineaarisen alueen keskeltä: 5,45 ml. (Ekvivalenttipiste voidaan määrittää myös derivaatan maksimikohdasta.)
- EDTA:n kulutus ekvivalenttipisteessä on annettava lukuarvona yksiköineen ja vähintään kahden desimaalin tarkkuudella.
10.2 Laske suuvesinäytteen fosfaatti-ionikonsentraatio. 13 p.
Titraukseen kuluneen EDTA:n ainemäärä:
n(EDTA) = c(EDTA) · V(EDTA) = 0,0150 mol/l · 0,00545 l = 8,175 · 10⁻⁵ mol
(1 p.)
- Väärät ekvivalenttipistekulutusarvot hyväksytään osatehtävästä 10.1 jos arvo on välillä 5−6 ml., muuten osatehtävästä korkeintaan 5 p., eli ratkaisun 1. vaiheen pisteet
Ratkaisun 1. vaihe:
Reaktioyhtälön kertoimien perusteella n(EDTA) on sama kuin liuokseen jääneiden Bi³⁺-ionien ainemäärä.
(2 p.)
- Pitää käydä ilmi, että kyseessä on Bi³⁺-ionien ylimäärä.
Osanäytteeseen lisätyn Bi(NO₃)₃-liuoksen ainemäärä:
n(Bi(NO₃)₃) = c(Bi(NO₃)₃) · V(Bi(NO₃)₃) = 0,0500 mol/l · 0,002000 l = 1,000 · 10⁻⁴ mol
(1 p.)
Saostuneen BiPO₄:n ainemäärä:
n(BiPO₄) = n(Bi³⁺)kok – n(Bi³⁺)ylimäärä
(2 p.)
Ratkaisun 2. vaihe:
n(BiPO₄) = 1,000 · 10⁻⁴ mol – 8,175 · 10⁻⁵ mol = 1,825 · 10⁻⁵ mol
(1 p.)
c(PO₄³⁻) 10,00 ml:n osanäytteessä:
n(PO₄³⁻) = n(BiPO₄)
(2 p.)
c(PO₄³⁻) = n(PO₄³⁻) / V = 1,825 · 10⁻⁵ mol / 0,01000 l = 0,001825 mol/l
(1 p.)
Ratkaisun 3. vaihe:
Alkuperäisen suuvesinäytteen fosfaatti-ionikonsentraatio:
c₁ · V₁ = c₂ · V₂
c₁ = (c₂ · V₂) / V₁
c₁ = (0,001825 mol/l · 0,1000 l) / 0,02500 l = 0,007300 mol/l
(2 p.)
≈0,00730 mol/l
(1 p.)
Vastaus: Alkuperäisen suuvesinäytteen konsentraatio oli 0,00730 mol/l.
10.3 Suuvesinäytteen fosfaatti voi olla liuoksen pH-arvosta riippuen \mathrm{PO_4^{3-}}-, \mathrm{HPO_4^{2-}}- tai \mathrm{H_2PO_4^-}-ioneina. Miksi myös \mathrm{HPO_4^{2-}} ja \mathrm{H_2PO_4^-} saostuvat vismuttifosfaattina \mathrm{BiPO_4}? 3 p.
Suuvesinäytteessä vallitsee tasapainotila PO₄³⁻-, HPO₄²⁻- ja H₂PO₄⁻-ionien välillä.
Tai
Kirjoitettu protolysoitumisreaktiot (ainakin toinen) tasapainoreaktioina.
Tai
HPO₄²⁻- ja /tai H₂PO₄⁻ ovat heikkoja happoja
(1 p.)
Kun PO₄³⁻ saostuu/poistuu BiPO₄:na, sitä muodostuu edelleen lisää HPO₄²⁻-ioneista, ja HPO₄²⁻-ioneita muodostuu lisää H₂PO₄⁻-ioneista.
(2 p.)
Siten kaikki liuoksessa olleet PO₄³⁻-, HPO₄²⁻- ja H₂PO₄⁻-ionit saostuvat BiPO₄:na.
- Vastauksessa pitää selittää, että fosfaatti-ionia poistuu, jotta sitä voi muodostua lisää.
11. Galvaaniset kennot 20 p.
11.1 Haluat valmistaa sähköparin, jonka lähdejännite on mahdollisimman suuri. Mitkä kaksi metallia valitset seuraavista: Ag, Cu, Al ja Ni? Esitä kennon osareaktiot ja kokonaisreaktio. Laske kennon lähdejännite. 6 p.
Valitaan metallit Ag ja Al.
(1 p.)
Osareaktiot:
Ag⁺(aq) + e⁻ → Ag(s) (E = 0,80 V)
(1 p.)
Al(s) → Al³⁺(aq) + 3e⁻ (E = 1,66 V)
(1 p.)
Kokonaisreaktio:
3Ag⁺(aq) + Al(s) → 3Ag(s) + Al³⁺(aq)
(1 p.)
Lähdejännite
E = 0,80 V + 1,66 V = 2,46 V
(2 p.)
11.2 Daniellin kennossa elektrodeina ovat sinkkilevy \mathrm{Zn^{2+}(aq)}-liuoksessa ja kuparilevy \mathrm{Cu^{2+}(aq)}-liuoksessa. Tutustu aineistoon ja selitä, miten \mathrm{Zn^{2+}}- ja \mathrm{Cu^{2+}}-konsentraatiot muuttuvat, kun kennolla tuotetaan sähkövirtaa. Kasvaako vai väheneekö tällöin kennon lähdejännite? Perustele vastauksesi Nernstin yhtälön avulla. 5 p.
Kupari on jalompi / kuparin pelkistyspotentiaali on isompi / sinkki on vähemmän jalo / sinkin pelkistyspotentiaali on pienempi. Tästä syystä liuoksen Cu²⁺-ionit pelkistyvät metalliseksi kupariksi. Metallinen sinkki hapettuu Zn²⁺-ioneiksi, jotka vapautuvat liuokseen. Siten c(Cu²⁺) vähenee ja c(Zn²⁺) kasvaa.
(1 p.)
- Pisteeseen vaaditaan, että Cu²⁺-ionien konsentraatio vähenee ja Zn²⁺-ionien konsentraatio kasvaa. Molemmat vaaditaan.
Tällöin Nernstin yhtälössä osoittaja kasvaa ja nimittäjä pienenee.
(2 p.)
- Tämän voi perustella myös esimerkkilaskulla.
Siten lähdejännitteen (E(kenno)) arvo pienenee.
(1 p.)
11.3
Tutustu aineistoon , jossa selitetään konsentraatiokennon toimintaperiaate. Tarkastellaan konsentraatiokennoa, jonka kumpikin elektrodi A ja B koostuu nikkelilevystä, joka on upotettu \mathrm{Ni^{2+}(aq)}-liuokseen. Näiden liuosten \mathrm{Ni^{2+}}-konsentraatiot ovat cA = 0,01 mol/l ja cB = 2,0 mol/l. Tällöin kennon lähdejännite on E(kenno) = +0,0681 V.
Määritä kennon E°(kenno)-arvo normaaliolosuhteissa. Tapahtuuko hapettuminen elektrodilla A vai B, ja kummalla elektrodilla tapahtuu pelkistyminen? Missä tilanteessa konsentraatiokenno ei enää tuota sähköenergiaa? Perustele vastauksesi.
6 p.
Koska kennon kumpikin elektrodi koostuu nikkelistä, kennon osareaktiot ovat:
- hapettumisreaktio:
Ni(s) → Ni²⁺(aq) + 2e⁻ , E = +0,26 V - pelkistymisreaktio:
Ni²⁺(aq) + 2e⁻ → Ni, E = −0,26 V.
Kokonaisreaktio on siten Ni(s) + Ni²⁺(aq) → Ni(s) + Ni²⁺(aq), ja kennon lähdejännite (E°(kenno)) on normaaliolosuhteissa 0,26 V + (−0,26 V) = 0,00 V.
(2 p.)
Pisteitys:
- Normaaliolosuhteissa jännite on 0,00 V (tai 0 V), 1 p.
- Perustelu, 1 p.
Nernstin yhtälön avulla voidaan päätellä, että ilmoitettu lähdejännitteen arvo 0,0681 V saadaan, kun lasketaan E(kenno) = E°(kenno) − 0,0296 V ∙ log10(0,01/2,0). Siten elektrodi B on katodi, ja pelkistyminen tapahtuu siinä. Vastaavasti hapettuminen tapahtuu elektrodilla A, joka on anodi.
(2 p.)
Pisteitys:
- Hapettuva ja pelkistyvä elektrodi tunnistettu, 1 p.
- Perustelu, 1 p., esimerkiksi
- Hapettuminen anodilla aiheuttaa liuoksen ionikonsentraation nousun ja pelkistyminen katodilla aiheuttaa liuoksen ionikonsentraation laskun
- Perustelu Nernstin yhtälön avulla
Nernstin yhtälöstä nähdään, että kun kennojen ionikonsentraatiot ovat samat, kennon lähdejännite on 0 V, ja tällöin kennosta ei voi saada sähkövirtaa.
(2 p.)
Pisteitys:
- Kun konsentraatiot ovat samat, sähköenergian tuotanto lakkaa, 1 p.
- Perustelu, 1 p., esimerkiksi
- Kun kennojen ionikonsentraatiot ovat samat, lähdejännite on 0 V.
- Perustelu Nernstin yhtälön avulla tai esimerkkilaskulla.
11.4 Pariston nimellinen jännite on 1,5 V. Miksi tämä jännite ei pysy vakiona vaan muuttuu ajan mittaan, kun paristosta otetaan sähköä? 3 p.
Kennon lähdejännite riippuu elektrolyyttien ionikonsentraatioista.
(2 p.)
Kun paristo tuottaa virtaa, ionikonsentraatiot muuttuvat, ja näin myös jännite muuttuu.
(1 p.)
- Vastauksessa jännite ja sen muutokset on liitettävä ionien tai elektrolyyttien konsentraatioihin ja näiden muutoksiin.