Hyvän vastauksen piirteet: FI – Kemia
21.9.2023
Lopulliset hyvän vastauksen piirteet 9.11.2023
Lopullisista hyvän vastauksen piirteistä ilmenevät perusteet, joiden mukaan koesuorituksen lopullinen arvostelu on suoritettu. Tieto siitä, miten arvosteluperusteita on sovellettu kokelaan koesuoritukseen, muodostuu kokelaan koesuorituksestaan saamista pisteistä, lopullisista hyvän vastauksen piirteistä ja lautakunnan määräyksissä ja ohjeissa annetuista arvostelua koskevista määräyksistä. Lopulliset hyvän vastauksen piirteet eivät välttämättä sisällä ja kuvaa tehtävien kaikkia hyväksyttyjä vastausvaihtoehtoja tai hyväksytyn vastauksen kaikkia hyväksyttyjä yksityiskohtia. Koesuorituksessa mahdollisesti olevat arvostelumerkinnät katsotaan muistiinpanoluonteisiksi, eivätkä ne tai niiden puuttuminen näin ollen suoraan kerro arvosteluperusteiden soveltamisesta koesuoritukseen.
Ylioppilastutkinnon kokeessa selvitetään, ovatko opiskelijat omaksuneet lukion opetussuunnitelman mukaiset tiedot ja taidot sekä saavuttaneet lukiokoulutuksen tavoitteiden mukaisen riittävän kypsyyden. Kemian kokeessa arvioinnin kohteina ovat kemiallisen tiedon ymmärtäminen ja soveltaminen. Arvioinnissa otetaan huomioon myös kokeellisen tiedonhankinnan ja ‐käsittelyn taidot. Näihin kuuluvat esimerkiksi kokeiden suunnittelu, työvälineiden ja reagenssien turvallinen käyttö, tulosten esittäminen ja tulkitseminen sekä johtopäätösten tekeminen ja soveltaminen.
Kemian tehtäviä arvosteltaessa painotetaan oppiaineen luonteen mukaista esitystapaa sekä käsitteiden ja kielenkäytön täsmällisyyttä. Reaktioyhtälöt esitetään ilman hapetuslukuja pienimmin mahdollisin kokonaislukukertoimin ja olomuodoilla varustettuna. Orgaanisissa reaktioyhtälöissä käytetään rakennekaavoja, mutta olomuotoja ei tarvitse mainita. Rakennekaavojen eri esitystavat hyväksytään.
Laskennallisissa tehtävissä suureyhtälöjä ja kaavoja käytetään tavalla, joka osoittaa kokelaan ymmärtäneen tehtävänannon oikein ja soveltaneen ratkaisussaan asianmukaista periaatetta tai lakia. Vastauksesta ilmenee yksiselitteisesti, miten lopputulokseen päädytään, mutta laajoja välivaiheita ei tarvita. CAS-ohjelmia voi hyödyntää tehtävän eri vaiheissa. Merkintätapojen kannalta keskeisiä vaiheita ovat periaatteiden ja lakien sekä lopputuloksen ja johtopäätösten esittäminen. Lopputulokset annetaan lähtöarvojen mukaisella tarkkuudella yksiköineen ja johtopäätökset perustellaan.
Mittaustuloksia ja niistä piirrettyjä kuvaajia hyödynnetään tiedon analysoinnissa ja johtopäätösten tekemisessä. Mittauspisteisiin sovitetaan asianmukainen suora. Mittauspisteiden välisiä arvoja voi interpoloida kuvaajaa silmämääräisesti lukemalla tai sopivalla ohjelmalla. Kuvaajaan merkitään akselien nimet, yksiköt ja asteikko. Kuvaajaan merkitään johtopäätösten kannalta olennaiset kohdat, kuten titrauskäyrän ekvivalenttikohta tai hetkellistä nopeutta laskettaessa kyseinen tangentti.
Essee‐ ja selittävissä vastauksissa tekstiä täydennetään reaktioyhtälöillä, kaavoilla tai piirroksilla. Käsiteltäviä ilmiöitä kuvataan makroskooppisella, mikroskooppisella ja symbolisella tasolla. Vastauksesta ilmenee, että tehtävään liittyvää aineistoa on hyödynnetty, sovellettu, analysoitu ja arvioitu tehtävänannon mukaisesti. Hyvä vastaus on jäsennelty ja sisällöltään johdonmukainen.
Vastaus arvostellaan tehtäväkohtaisten kriteerien mukaisesti. Lähtökohtana ovat vastauksen ansiot, joista kertyy pisteitä. Jos keskeinen kemiallinen periaate puuttuu tai se on virheellinen, pisteiden kertyminen päättyy. Tällöin virheellisen tuloksen siirtymistä eteenpäin ei hyväksytä (ei-VSE). Tällaiset virheet ovat esimerkiksi stoikiometriavirheet, väärä rajoittava tekijä tai väärä aine reaktioyhtälössä. Muiden puutteiden tai virheiden tapauksessa virheellisen tuloksen siirtyminen eteenpäin hyväksytään (VSE), jolloin pisteiden kertyminen jatkuu puutteen tai virheen jälkeen. Kokeen osan 3 vaativat tehtävät edellyttävät täsmällisempää periaatteiden hallintaa kuin kokeen alkupään perustehtävät. Kemian kannalta epätäsmällisestä kielenkäytöstä, pienestä laskuvirheestä tai likiarvojen huolimattomasta käytöstä vähennetään 0–3 p. esimerkiksi seuraavasti:
- pyöristys- ja kopiointivirheet, jotka eivät vaikuta lopputulokseen, −0 p.
- kopiontivirheet, pyöristysvirheet ja pienet huolimattomuusvirheet, jotka vaikuttavat lopputulokseen, yksittäinen pieni virhe rakennekaavassa −1 p.
- yksikönmuunnosvirheet, systemaattinen virhe rakennekaavassa tai muut vähäistä suuremmat virheet, jossa ei kuitenkaan ole väärä kemiallinen periaate −2 p.
22.9.2023 korjattu kirjoitusvirheet osatehtävissä 4.1 ja 5.2 sekä yksikköä osatehtävässä 8.2.
10.11.2023 klo 9.30 lisätty puuttuva yhtälö pisteineen osatehtävään 9.2.
Osa 1: 20 pisteen tehtävä
1. Monivalintatehtäviä kemian eri osa-alueilta 20 p.
1.1 Mikä seuraavista on puhdas aine? 2 p.
- sakkaroosi (2 p.)
1.2 Mikä seuraavista vaikuttaa eniten puhtaan aineen haihtuvuuteen? 2 p.
- molekyylien välisten sidosten voimakkuus (2 p.)
1.3 Mikä seuraavista uuttoon liittyvistä väitteistä on virheellinen? 2 p.
- Uutossa käytetään liikkuvaa faasia. (2 p.)
1.4 Mihin perustuu UV-VIS-spektroskopia eli näkyvään valoon ja ultraviolettialueen säteilyyn pohjautuva spektroskopia? 2 p.
- elektronien energiatilojen välisiin virityksiin (2 p.)
1.5 Seuraavilla atomeilla tai ioneilla on sama määrä elektroneja. Millä atomilla tai ionilla on pienin säde? 2 p.
- \mathrm{K}^{+} (2 p.)
1.6 Millä seuraavista yhdisteistä esiintyy enantiomeriaa (peilikuvaisomeriaa eli optista aktiivisuutta)? 2 p.
-
(2 p.)
1.7 Mikä seuraavista muoveihin liittyvistä väitteistä on virheellinen? 2 p.
- Kertamuoveilla on tarkka sulamispiste. (2 p.)
1.8 Millä seuraavista yhdisteistä on korkein kiehumispiste? 2 p.
- propan-1-oli (2 p.)
1.9 Millä seuraavista yhdisteistä on suurin liukoisuus veteen huoneenlämpötilassa? 2 p.
- NH₃(g) (2 p.)
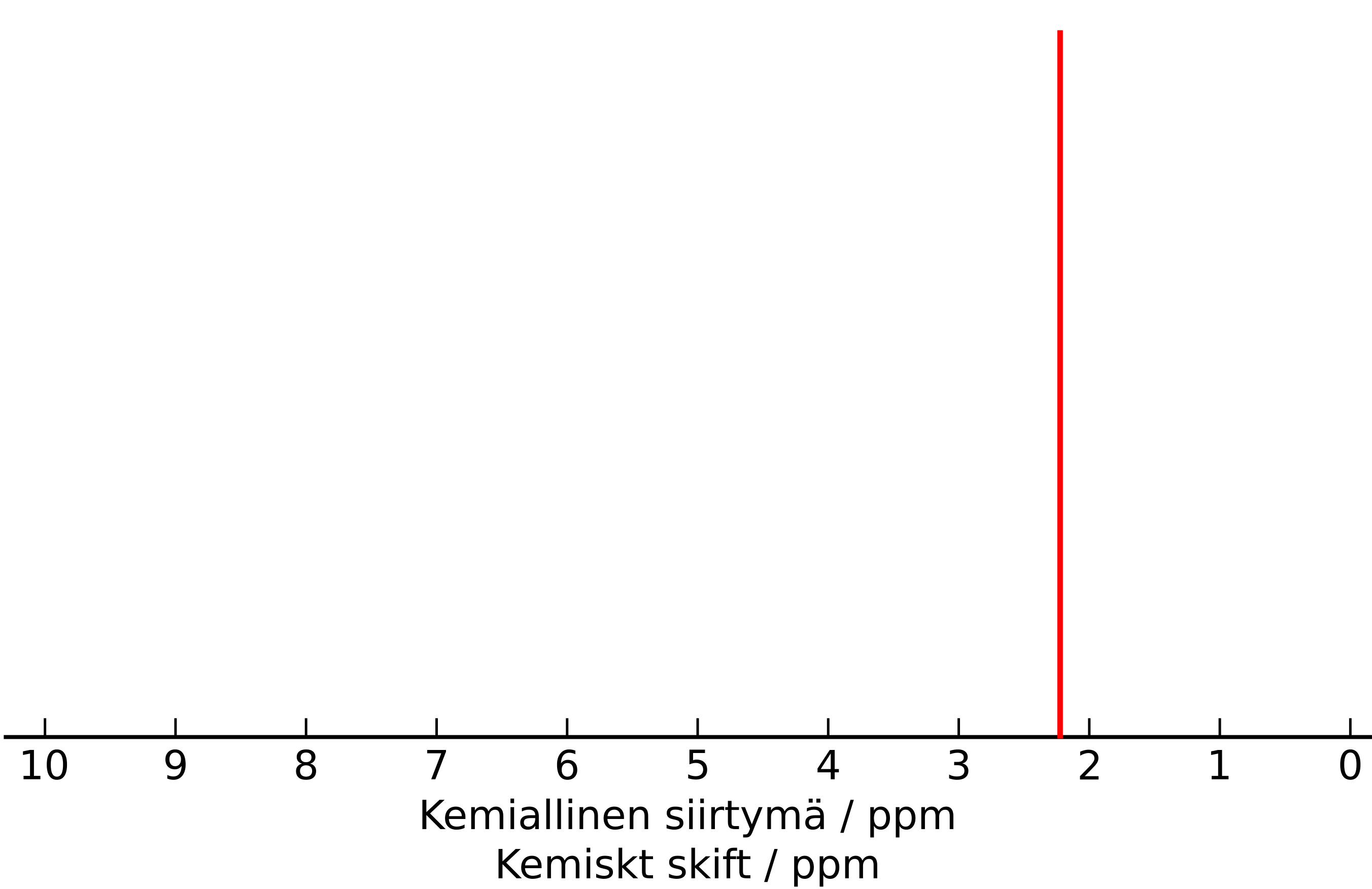
1.10 Värittömän, nestemäisen yhdisteen molekyylikaavaksi määritettiin C₃H₆O. Siitä mitattiin 1H-NMR-spektri, joka on esitetty alla. Mikä yhdiste on kyseessä? 2 p.
-
 (2 p.)
(2 p.)
Osa 2: 15 pisteen tehtävät
2. Termiittireaktio 15 p.
Fe₂O₃(s) + 2Al(s) → 2Fe(l) + Al₂O₃(s).
2.1 Eräässä laboratoriokokeessa tutkittiin tätä termiittireaktiota käyttäen lähtöaineina 3,85 g alumiinia ja 10,2 g rauta(III)oksidia. Kuinka monta grammaa rautaa muodostui? 9 p.
n(Al) = m(Al) / M(Al) = 3,85 g / (26,98 g/mol) = 0,14270 mol
(1 p.)
ja
n(Fe₂O₃) = m(Fe₂O₃) / M(Fe₂O₃) = 10,2 g / (159,70 g/mol) = 0,063870 mol.
(1 p.)
Rajoittavan tekijän päättely ja perustelu, esimerkiksi:
Reaktioyhtälön mukaan 2 moolia alumiinia ja 1 mooli rauta(III)oksidia reagoivat keskenään, eli tarvittava rautaoksidin ainemäärä on n(Fe₂O₃) = 0,5 · n(Al) = 0,5 · 0,14270 mol = 0,071350 mol. Koska saatavilla on tätä vähemmän rautaoksidia, rautaoksidi on rajoittava tekijä.
(3 p.)
- Rajoittava tekijä on perusteltu 2 p. Rajoittava tekijä on valittu oikein 1 p. Jälkimmäinen piste on sidottu siihen, että molemmat ainemäärät on laskettu.
- Jos rajoittava tekijä on valittu väärin pienen huolimattomuusvirheen takia, stoikiometriasuhteen pisteet menetetään huolimattomuusvirheestä aiheutuneen vähennyksen lisäksi, mutta muut pisteet voi edelleen ansaita. Jos rajoittava tekijä on valittu väärin muusta syystä, pisteiden kertyminen päättyy.
n(Fe) = 2 · n(Fe₂O₃) = 2 · 0,063870 mol = 0,12774 mol
(2 p.)
- Mikäli stoikiometriassa on virhe, pisteiden kertyminen päättyy.
m(Fe) = n(Fe) · M(Fe) = 0,12774 mol · 55,85 g/mol = 7,1343 g
(1 p.)
Vastaus: Rautaa muodostui 7,13 g (7,1 g tai 7,134 g).
(1 p.)
2.2 Onko reaktio hapettumis-pelkistymisreaktio? Perustele vastauksesi. 3 p.
Reaktio on hapettumis-pelkistymisreaktio.
(1 p.)
Raudan hapetusluku lähtöaineissa on +3 ja tuotteissa 0,
(1 p.)
kun taas alumiinin hapetusluku lähtöaineissa on 0 ja tuotteissa +3.
(1 p.)
TAI
Lähtöaineissa alumiini on alkuainemuodossa, ja tuotteissa se on ionimuodossa.
(1 p.)
Rauta on lähtöaineissa ionimuodossa ja tuotteissa alkuainemuodossa.
(1 p.)
- Jos todettu vain, että alumiini hapettuu ja rauta pelkistyy, 1 p. perustelusta.
2.3 Onko reaktio endoterminen vai eksoterminen? Perustele vastauksesi. 3 p.
Reaktio on eksoterminen (1 p.), koska reaktiossa vapautuu lämpöenergiaa (1 p.).
Perustelu, esimerkiksi:
Tämän huomaa siitä, että rauta sulaa reaktiossa / raudan olomuoto tuotteiden puolella on neste (l). (1 p.)
TAI
Koska termiittireaktiossa vapautuu lämpöä. (1 p.)
- Vastauksessa hyväksytään myös tarkastelu muodostumisentalpioiden avulla (joka on virheellinen, jos ei ole käytetty nestemäisen raudan muodostumisentalpiaa), jos lukuarvoksi on saatu –847,8 kJ/mol tai –848 kJ/mol tai –850 kJ/mol.
3. Tuntemattomat aineet 15 p.
3.1
Yhdiste X on valkea jauhe, joka reagoi vetykloridihapon kanssa. Reaktiossa vapautuu kaasua.
Atomiabsorptiospektroskopian avulla voitiin osoittaa, että X sisälsi kalsiumioneja, mutta ei muita metalleja.
Yhdisteen X moolimassaksi määritettiin noin 100 g/mol, mutta moolimassaa ei pystytty määrittämään tarkasti.
Termogravimetrinen analyysi osoitti, että kun yhdistettä X kuumennettiin, siitä poistui kaasua. Tämä kaasu tunnistettiin hiilidioksidiksi. Kuumennuksen jälkeen jäljelle jäi hieman tummemman väristä jauhetta Y. Kuumennuksen reaktio voidaan siis kirjoittaa seuraavasti: X → Y + CO₂(g).
Jauhe Y liukeni huonosti veteen, mutta muodosti selkeästi emäksisen vesiliuoksen.
Nimeä yhdisteet X ja Y. Kirjoita reaktioyhtälö yhdisteen Y reaktiolle veden kanssa.
7 p.
Yhdiste X on kalsiumkarbonaatti/CaCO₃.
(2 p.)
Yhdiste Y on kalsiumoksidi/CaO.
(2 p.)
- Ei hyväksytä kalkkia tai kalsiumvetykarbonaattia.
Yhdisteen Y reaktio veden kanssa:
CaO(s) + H₂O(l) → Ca(OH)₂(aq/s)
(3 p.)
- Aineet oikein 1 p., kertoimet oikein 1 p. ja olomuodot oikein 1 p. Kertoimien ja olomuotojen pisteet on sidottu oikeisiin aineisiin. Jos reaktiossa on ylimääräinen tai puuttuva aine, 0 p. Väärät varaukset tulkitaan vääriksi aineiksi.
3.2
Yhdiste P on väritön neste. Alkuaineanalyysin perusteella yhdiste P koostuu vedystä, hiilestä ja hapesta.
Yhdisteestä P mitattiin massaspektri, joka on aineistossa .
Yhdisteen P vesiliuosta kuumennettiin reaktorissa. Kromatografian avulla selvitettiin, että vesiliuokseen muodostui tasapainoreaktiossa kahta muuta yhdistettä Q ja R. Vesiliuos muuttui reaktion aikana lievästi happamaksi. Lisäkokeiden perusteella pääteltiin, että Q on alkoholi.
Nimeä yhdisteet P, Q ja R tai esitä niiden rakennekaavat. Mihin yhdisteluokkiin yhdisteet P ja R kuuluvat?
8 p.
4. Lääkeaineen synteesi 15 p.
Haloperidoli on lääkeaine, jota käytetään skitsofrenian ja kaksisuuntaisen mielialahäiriön hoidossa. Synteesin eräs välituote R1 on esitetty aineistossa ja koko kolmivaiheinen synteesireitti on esitetty synteesikaaviona aineistossa . Teollisessa synteesissä kukin vaihe tehdään erikseen ja välituotteet eristetään.
Tutustu aineistoihin ja ja tee osatehtävät 4.1–4.4.
4.1 Kun eräässä tehtaassa valmistettiin haloperidolia, käytettävissä oli 6,44 kg välituotetta R1 (C₁₁H₁₄Br₂ClN). Välituotetta S saatiin eristettyä vaiheen 2 reaktiosta 3,06 kg. Laske vaiheen 2 saantoprosentti. 6 p.
n(R1) = m(R1) / M(R1) = 6 440 g / (355,482 g/mol) = 18,1162 mol
ja
n(S) = m(S) / M(S) = 3 060 g / (211,682 g/mol) = 14,4556 mol.
(3 p.)
- R:n moolimassa oikein 1 p., S:n moolimassa oikein 1 p., molemmat ainemäärät oikein 1 p.
Saantoprosentti = 14,4556 mol / 18,1162 mol
(1 p.)
= 79,7938 %.
(1 p.)
Vastaus: Saantoprosentti on 79,8 % (80 % tai 79,79 %).
(1 p.)
4.2 Tasapainota vaiheen 2 reaktioyhtälö. Voit käyttää vastauksessasi kirjainsymboleja R1 ja S. 2 p.
R1 + 2NaOH(aq) ⇌ S + 2NaBr(aq) + H₂O(l)
(2 p.)
- Huomioitu, että reaktiossa muodostuu vettä 1 p., reaktioyhtälö oikein 1 p.
- Tässä osatehtävässä poikkeuksellisesti olomuotoja ei huomioida pisteytyksessä.
4.3 Esitä lähtöaineen P rakenne. 4 p.
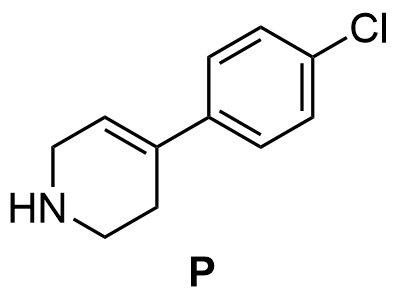 Yhdisteen P rakennekaava
Yhdisteen P rakennekaava
Kaksoissidos oikeassa paikassa
(2 p.)
Aminoryhmä oikeassa paikassa ja oikealla protonoitumisasteella
(2 p.)
- Molekyylin rungon pitää olla oikein pisteiden saamiseksi.
- Jos typpi puuttuu, koko rakenteesta 0 p.
- Ylimääräiset heteroatomit kiinni rungossa, –2 p. per atomi. Jos rungossa on kiinni yksi bromiatomi samassa kohdassa kuin yhdisteissä R1 ja R2, menetetään vain kaksoissidospisteet.
4.4 R1 ja R2 ovat isomeerejä. Mistä isomerian lajista on kyse? Perustele, miksi vaiheessa 1 syntyi pääasiassa isomeeriä R1 eikä käytännössä lainkaan isomeeriä R2. 3 p.
R1 ja R2 ovat keskenään paikkaisomeerejä.
(1 p.)
Isomeeriä R1 syntyy enemmän, koska additioreaktio noudattaa Markovnikovin sääntöä: vety liittyy siihen hiileen, jossa on ennestään enemmän vetyjä.
(2 p.)
- Pisteet Markovnikovin säännöstä voi ansaita vain, jos osatehtävässä 4.3 kaksoissidos on piirretty oikeaan kohtaan.
5. Elektrolyysi 15 p.
5.1 Mikä alkuaine hapettuu ja mikä pelkistyy, kun elektrolysoidaan sulaa magnesiumkloridia? Kirjoita hapettumis- ja pelkistymisreaktioiden reaktioyhtälöt. 5 p.
Kloori hapettuu ja magnesium pelkistyy.
(1 p.)
2Cl⁻ → Cl₂ + 2e⁻
(2 p.)
Mg²⁺ + 2e⁻ → Mg
(2 p.)
- Olomuotoja ei vaadita osareaktioissa, mutta vääristä olomuodoista (esimerkiksi Cl⁻(aq) ja Mg²⁺(aq)) –1 p. kertavähennyksenä.
- Jos reaktiossa on ylimääräisiä tai puuttuvia aineita, 0 p. reaktiosta. Virheelliset varaukset tulkitaan vääräksi aineeksi.
5.2 Mitä hapettumis- ja pelkistymisreaktioita tapahtuu, kun lämpötilassa 25 °C elektrolysoidaan litiumjodidin vesiliuosta, jonka konsentraatio on 1,0 mol/l? Kirjoita reaktioyhtälöt ja perustele, miksi nämä reaktiot tapahtuvat. 6 p.
Vastaus perustellaan tapahtuvien hapettumis- ja pelkistymisreaktioiden avulla.
Mahdolliset hapettumisreaktiot:
2I⁻ → I₂ + 2e⁻, E = −0,54 V
(1 p.)
2H₂O → O₂ + 4H⁺ + 4e⁻, E = −1,23 V
(1 p.)
- Jokainen väärä reaktioyhtälö kumoaa oikean reaktioyhtälön.
- Normaalipotentiaalien arvoja ei vaadita reaktioyhtälöpisteisiin, mutta ne vaaditaan perustelupisteeseen.
Jodin hapettumisreaktiolla on suurempi normaalipotentiaali, joten se tapahtuu.
(1 p.)
- Piste on sidottu oikeisiin reaktioihin (molemmat oltava oikein).
Mahdolliset pelkistymisreaktiot:
Li⁺ + e⁻ → Li, E = −3,04 V
(1 p.)
2H₂O + 2e⁻ → H₂ + 2OH⁻, E = −0,83 V
(1 p.)
- Jokainen väärä reaktioyhtälö kumoaa oikean reaktioyhtälön.
- Normaalipotentiaalien arvoja ei vaadita reaktioyhtälöpisteisiin, mutta ne vaaditaan perustelupisteeseen.
Veden pelkistymisreaktiolla on suurempi normaalipotentiaali, joten se tapahtuu.
(1 p.)
- Piste on sidottu oikeisiin reaktioihin (molemmat oltava oikein).
- Jos termit hapettuminen ja pelkistyminen ovat väärin päin, –2 p.
- Vain jodin hapettumisreaktion ja veden pelkistymisreaktion reaktioyhtälöt vaaditaan. Veden hapettumisen ja litiumin pelkistymisen voi käsitellä sanallisesti.
5.3 Sinkin tuotannossa sinkki puhdistetaan sinkkisulfaatin vesiliuoksen elektrolyysillä. Miksi magnesiumia pitää kuitenkin tuottaa elektrolyysissä sulasta magnesiumkloridista eikä magnesiumkloridin vesiliuoksesta? 4 p.
Magnesiumkloridi on elektrolysoitava sulatteesta, koska vesiliuoksesta pelkistyisi ja hapettuisi vesi.
(2 p.)
Perustelut:
Veden pelkistymisreaktion normaalipotentiaali on suurempi/positiivisempi kuin magnesiumionin pelkistymisreaktion normaalipotentiaali.
(2 p.)
- Veden ja magnesiumin pelkistymisreaktioiden vertailu 1 p., johtopäätös, että reaktio, jolla on suurempi normaalipotentiaali, tapahtuu 1 p.
- Perustelussa ei vaadita lukuarvoja.
6. Liukeneminen 15 p.
6.1 Mitä havaintoja ja mitä johtopäätöksiä voit tehdä videoissa ja tapahtuvista liukenemisprosesseista? Perustele tekemäsi johtopäätökset. 6 p.
Maksimissaan 6 p. seuraavista:
Havainnot:
Lämpötila on alussa tai lopussa kummassakin astiassa tasainen.
TAI
Kirjattu molempien videoiden osalta alku- ja loppulämpötilat.
(1 p.)
Kun CaCl₂ kaadetaan astiaan, lämpötila nousee.
(1 p.)
Kun NH₄Cl kaadetaan astiaan, lämpötila laskee.
(1 p.)
Johtopäätökset:
Lämmön siirtymistä ympäristöön/ympäristöstä ei tapahdu.
(2 p.)
CaCl₂:n liukeneminen on eksoterminen prosessi / vapauttaa lämpöenergiaa.
(2 p.)
NH₄Cl:n liukeneminen on endoterminen prosessi / sitoo lämpöenergiaa.
(2 p.)
6.2
Tarkastellaan kalsiumkloridin liukenemista videossa . Mitkä sidokset katkeavat ja mitkä muodostuvat videossa tapahtuvassa prosessissa? Nimeä sidosten sidostyypit.
Missä näistä tapahtumista energiaa vapautuu ja missä energiaa sitoutuu? Mikä määrittää sen, onko liukeneminen endoterminen vai eksoterminen prosessi?
9 p.
Seuraavista maksimissaan 4 p.:
Ca²⁺- ja Cl⁻-ionien välinen ionisidos
(1 p.)
ja vesimolekyylien välisiä vetysidoksia
(1 p.)
- Pisteet edellyttävät sidoksen oikean nimeämisen ja kohdistamisen.
- Jokainen väärä sidostyyppi kumoaa oikean sidostyypin.
- Jos CaCl₂:n ionisidos on kohdistettu alkuaineiden, atomien tai molekyylin välille, tai jos kloridi-ionin tilalla on kloori-ioni, 0 p. ionisidoksesta, mutta sidotut pisteet voi ansaita.
katkeaa,
(1 p.)
- Piste on sidottu jompaankumpaan sidostyyppipisteeseen.
jonka seurauksena sitoutuu energiaa.
TAI
Sidoksen katkeaminen on endoterminen tapahtuma.
(1 p.)
- Piste on sidottu pisteeseen sidosten katkeamisesta.
Seuraavista maksimissaan 3 p.:
Ca²⁺- ja vesimolekyylien sekä Cl⁻-ionien ja vesimolekyylien välisiä ioni-dipolisidoksia
(1 p.)
- Pisteet vaativat sidoksen oikean nimeämisen ja kohdistamisen.
- Väärä sidostyyppi kumoaa oikean sidostyypin.
muodostuu,
(1 p.)
- Piste on sidottu ioni-dipolisidospisteeseen.
jonka seurauksena vapautuu energiaa.
TAI
Sidoksen muodostuminen on eksoterminen tapahtuma.
(1 p.)
- Piste on sidottu pisteeseen sidosten muodostumisesta.
Prosessin ekso-/endotermisyyden tarkastelu:
Prosessi on eksoterminen, jos muodostuvien uusien sidosten kokonaisenergia (sidosenergia kertaa sidosten lukumäärä) on suurempi kuin katkeavien sidosten kokonaisenergia (sidosenergia kertaa sidosten lukumäärä).
TAI
Prosessi on endoterminen, jos muodostuvien uusien sidosten kokonaisenergia (sidosenergia kertaa sidosten lukumäärä) on pienempi kuin katkeavien sidosten kokonaisenergia (sidosenergia kertaa sidosten lukumäärä).
(3 p.)
- Sidosten katkeamisessa sitoutuvan energian ja muodostumisessa vapautuvan energian vertailu, 2 p. Tehty oikea johtopäätös ekso- /endotermisyydestä, 1 p. Johtopäätöspiste on sidottu oikeaan perusteluun.
7. Hypokloorihapokkeen titraus 15 p.
7.1
Opiskelija halusi selvittää laboratoriossa säilytetyn hypokloorihapokeliuoksen (HClO) tarkan konsentraation. Hän päätti tehdä määrityksen titraamalla. Titrausta varten opiskelija valmisti natriumhydroksidiliuoksen liuottamalla 4,535 g natriumhydroksidirakeita veteen siten, että liuoksen lopputilavuus oli 1 000,0 ml. Oletetaan, että natriumhydroksidirakeet olivat vedettömiä. Opiskelija siirsi 10 ml tutkittavaa hypokloorihapokeliuosta täyspipetillä erlenmeyerpulloon ja lisäsi muutaman pisaran indikaattoriliuosta. Titrauksessa natriumhydroksidiliuoksen kulutus oli 18,1 ml. Hypokloorihapokkeen happovakio Kₐ on 3{,}0\cdot 10^{-8} mol/l.
Kirjoita opiskelijan kokeessa tapahtuvan titrausreaktion yhtälö.
Mikä oli hypokloorihapokeliuoksen konsentraatio?
9 p.
Reaktioyhtälö: HClO(aq) + NaOH(aq) → ClONa(aq) + H₂O(l)
(3 p.)
- Aineet oikein 1 p., kertoimet oikein 1 p. ja olomuodot oikein 1 p. Kertoimien ja olomuotojen pisteet on sidottu oikeisiin aineisiin. Jos reaktiossa on ylimääräinen tai puuttuva aine, 0 p. Väärät varaukset tulkitaan vääriksi aineiksi.
- Natriumkloraatin eri kirjoitusasut hyväksytään niin kauan, kun kloorin ja hapen symbolit ovat kaavassa peräkkäin.
Natriumhydroksidin ainemäärä ja valmistetun liuoksen konsentraatio:
n(punnittu NaOH) = m/M = 4,535 g / (39,998 g/mol) = 0,11338 mol
(1 p.)
c(NaOH-liuos) = n/V = 0,11338 mol / (1,000 l) = 0,11338 mol/l.
(1 p.)
n(NaOH-kulutus) = c · V = 0,11338 mol/l · 18,1 · 10⁻³ l = 2,0522 · 10⁻³ mol
(1 p.)
Reaktioyhtälön mukaan n(HClO) = n(NaOH)
(1 p.)
- jos reaktioyhtälössä on väärä stoikiometria, tätä ja seuraavia pisteitä ei ansaita.
Hypokloorihapokeliuoksen konsentraatio:
c(HClO) = n/V = 2,0522 · 10⁻³ mol / (10,0 · 10⁻³ l) = 0,20522 mol/l
(1 p.)
Vastaus: Hypokloorihapokeliuoksen konsentraatio oli 0,205 mol/l (0,2052 mol/l tai 0,21 mol/l).
(1 p.)
7.2
Hypokloorihapokeliuoksen pitoisuus muuttuu säilytyksen aikana, koska HClO-molekyyli hajoaa hitaasti. Tällöin muodostuu kaksi tuotetta. Toinen tuote on happikaasu ja toinen tuote reagoi veden kanssa.
Kirjoita hypokloorihapokkeen hajoamisen reaktioyhtälö.
Muuttuuko liuoksen pH säilytyksen aikana? Perustele vastauksesi.
6 p.
Reaktioyhtälö: 2HClO(aq) → 2HCl(aq/g) + O₂(g/aq)
(3 p.)
- Aineet oikein 1 p., kertoimet oikein 1 p. ja olomuodot oikein 1 p. Kertoimien ja olomuotojen pisteet on sidottu oikeisiin aineisiin. Jos reaktiossa on ylimääräinen tai puuttuva aine, 0 p. Väärät varaukset tulkitaan vääriksi aineiksi.
pH muuttuu.
(1 p.)
- Pisteen ansaitsee, vaikka pH:n muuttuminen olisi selitetty väärin ja/tai väärään suuntaan.
Muodostuva HCl on vahva happo, jonka molekyyleistä lähes kaikki luovuttavat protonin.
(1 p.)
- Perustelun voi esittää myös reaktioyhtälöillä.
Tämän vuoksi liuoksen pH pienenee / happamuus lisääntyy.
(1 p.)
- Piste on sidottu oikeaan perusteluun.
8. Veden fluoridi-ionipitoisuuden määritys 15 p.
Suomen vesistöissä fluoridi-ioneja on yleensä niukasti lukuun ottamatta rapakivialueita, joilla pohjaveden fluoridipitoisuus voi olla useita milligrammoja litrassa. Fluoridi muun muassa ehkäisee hampaiden reikiintymistä, mutta toisaalta sen liiallisella saannilla on haitallisia terveysvaikutuksia. Siksi talousveden fluoridipitoisuuden raja-arvo on 1,5 mg/l.
Veden fluoridi-ionipitoisuus voidaan määrittää fluoridi-ionielektrodilla, joka tunnistaa selektiivisesti fluoridi-ionit. Elektrodi ilmoittaa mittaustuloksen sähköisenä potentiaalina, jonka yksikkö on millivoltti. Kun näytteen fluoridi-ionipitoisuus kasvaa, sähköinen potentiaali pienenee.
8.1 Kaivoveden fluoridi-ionipitoisuuden määritystä varten natriumfluoridista valmistettiin 1 000 ml:n mittapulloon perusliuos, jonka fluoridi-ionipitoisuus oli 100,0 mg/l. Kuinka monta grammaa natriumfluoridia oli punnittava? 5 p.
1 000 ml:n mittapullossa fluoridi-ioneja tarvitaan 100,0 mg. Lasketaan vastaava ainemäärä:
n(F⁻) = m / M = 0,1000 g / (19,00 g/mol) = 0,00526316 mol.
(1 p.)
Lasketaan natriumfluoridin ainemäärä ja massa:
n(F⁻) = n(NaF)
(2 p.)
M(NaF) = 41,99 g/mol
m(NaF) = n(NaF) · M(NaF) = 0,00526316 mol · 41,99 g/mol = 0,22100 g
(1 p.)
= 0,2210 g (0,221 g tai 0,22100 g)
(1 p.)
8.2 Perusliuoksen fluoridi-ionipitoisuus oli 100,0 mg/l. Siitä valmistettiin laimentamalla työliuos toiseen mittapulloon. Työliuoksen fluoridi-ionipitoisuus oli 10,0 mg/l ja mittapullon tilavuus 50 ml. Kuinka paljon perusliuosta oli pipetoitava? 4 p.
Työliuokseen pipetoitava massa lasketaan kertomalla työliuoksen pitoisuus (mg/l) tilavuudella (ml):
m = c · V
(1 p.)
- Jos konsentraation tai pitoisuuden sijasta on puhuttu tiheydestä tai käytetty tiheyden symbolia ρ, 0 p. suureyhtälöstä.
= 10,0 (mg/l) · 0,0500 l = 0,500 mg.
(1 p.)
Pipetoitavan perusliuoksen tilavuus lasketaan jakamalla pipetoitava massa (mg) perusliuoksen pitoisuudella (mg/l):
V = 0,500 mg / (100,0 mg/l)
(1 p.)
= 0,00500 l = 5,00 ml (5 ml tai 5,0 ml tai 5,000 ml).
(1 p.)
- Tehtävän voi ratkaista myös käyttäen yhtälöä ctyöliuosVtyöliuos = cperusliuosVperusliuos, missä konsentraation yksikkönä on käytetty mg/l tai mol/l. Tällöin yhtälö 1 p., lasku 2 p. ja vastaus 1 p.
8.3
Standardiliuokset valmistettiin laimentamalla työliuosta. Kaivovesinäytteen mittausta varten dekantterilasiin pipetoitiin 25,0 ml näytettä ja 25,0 ml puskuriliuosta. Kukin standardiliuos ja puskuroitu vesinäyte analysoitiin fluoridi-ionidetektorilla. Tulokset on esitetty aineistossa . Taulukon toisessa sarakkeessa pitoisuuden arvoista on otettu kymmenkantainen logaritmi, jotta kaivovesinäyte saataisiin luettua standardisuoralta. (Kuvaaja, jossa E on esitetty pitoisuuden funktiona, ei ole suora. Sen sijaan kuvaaja, jossa E on esitetty pitoisuuden logaritmin funktiona, on suora.)
Piirrä aineiston perusteella standardisuora ja määritä suoralle yhtälö. Merkitse standardisuoran pystyakselille E(mV) ja vaaka-akselille lg(pitoisuus/(mg/l)). Määritä kaivovesinäytteen fluoridi-ionipitoisuus suoran yhtälön avulla.
6 p.
Kuvaaja Geogebralla tuotettuna:
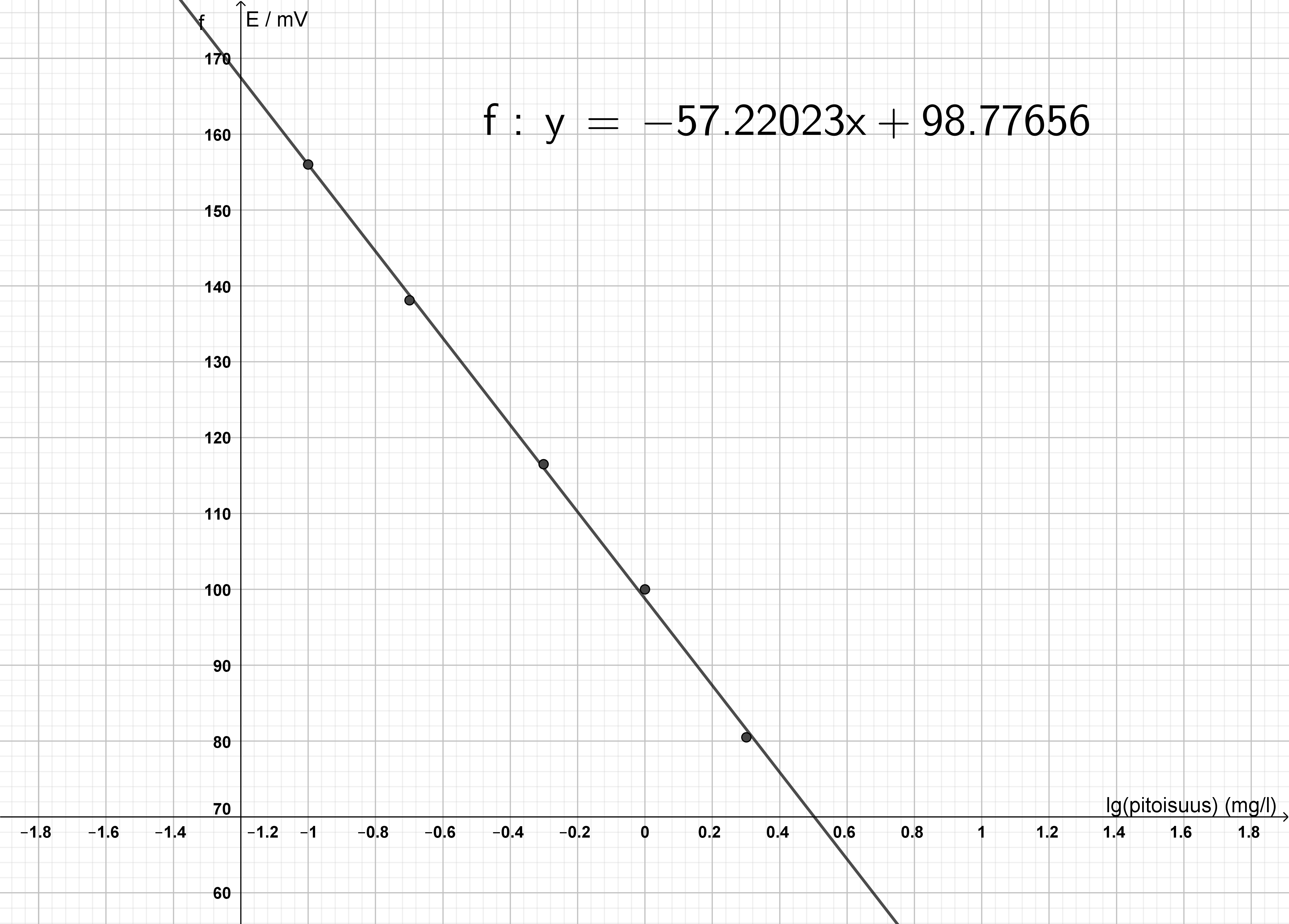 Esimerkki tehtävässä laadittavasta kuvaajasta
Esimerkki tehtävässä laadittavasta kuvaajasta
Suoran yhtälö: y = −57,22023x + 98,77656.
(2 p.)
- Mittapisteet merkitty kuvaajaan oikein tai suora oikein, 1 p. Suoran yhtälö, 1 p.
- Jos suoran sijaan on sovitettu eksponenttifunktio tai joku muu korkeamman asteen funktio, pisteiden kertyminen päättyy.
(Yksiköt on jätetty selvyyden vuoksi pois.)
Näytteen mittaustulos saadaan taulukosta: 90,6 mV.
x saadaan suoran yhtälöstä: 0,142896 mg/l.
(1 p.)
lg(pitoisuus/(mg/l)) = 0,142896, josta
pitoisuus: 100,142896 mg/l = 1,3896 mg/l.
(1 p.)
Koska kaivovesinäytteeseen lisättiin analyysiä varten puskuriliuosta sama tilavuus kuin näyteliuosta, todellinen pitoisuus on kaksi kertaa suurempi
(1 p.)
eli 2,78 mg/l (2,8 mg/l tai 2,779 mg/l).
(1 p.)
Osa 3: 20 pisteen tehtävät
9. Amiinin synteesi 20 p.
9.1 Synteesissä käytettiin 2,000 grammaa yhdistettä X ja tuotteena saatiin 1,357 grammaa amiinia Z. Prosentuaalinen saanto oli 89 %. Amiinin Z alkuaineanalyysi osoitti, että yhdisteen massaprosenttinen koostumus oli seuraava: C 67,26 %, H 8,47 %, N 4,36 %, O 19,91 %. Mikä on amiinin Z molekyylikaava? 12 p.
Suhdekaavan laskeminen:
Sadassa grammassa yhdistettä on
m(C) = 67,26 g
m(H) = 8,47 g
m(N) = 4,36 g
m(O) = 19,91 g
Lasketaan massoja vastaavat ainemäärät:
n(C) = m(C) / M(C) = 67,26 g / 12,01 g/mol = 5,600 mol
n(H) = m(H) / M(H) = 8,47 g / 1,008 g/mol = 8,402 mol
n(N) = m(N) / M(N) = 4,36 g / 14,01 g/mol = 0,3112 mol
n(O) = m(O) / M(O) = 19,91 g / 16,00 g/mol = 1,244 mol
Jaetaan ainemäärät pienimmällä ainemäärällä eli typen ainemäärällä:
n(C) / n(N) = 5,600… mol / 0,3112… mol = 17,996 ≈ 18
n(H) / n(N) = 8,402… mol / 0,3112… mol = 27,001 ≈ 27
n(N) / n(N) = 0,3112… mol / 0,3112… mol = 1,000 ≈ 1
n(O) / n(N) = 1,244… mol / 0,3112… mol = 3,998 ≈ 4
(2 p.)
- Aineiden ainemäärät on laskettu käyttäen mitä tahansa massaa, 1 p. Suhdekaavan lukuarvot on laskettu jakamalla pienimmällä ainemäärällä, 1 p.
Suhdekaava on C₁₈H₂₇NO₄
(2 p.)
- Kirjoitettu kaava oikeilla lukuarvoilla, 1 p. Kaavasta käy ilmi sanallisesti tai matemaattisesti merkittynä, että tarkoitetaan suhdekaavaa, 1 p.
Saantoprosentin huomioiminen:
m(X) = 2,000 g
m(Z, saanto-% 89 %) = 1,357 g
Lasketaan, kuinka paljon reaktiossa olisi voinut korkeintaan muodostua yhdistettä Z, jos saanto olisi ollut 100 %:
m(Z, saanto-% 100 %) = m(Z, saanto-% 89 %) / 0,89 = 1,357 g / 0,89 = 1,5247191 g.
(2 p.)
Stoikiometrian huomioiminen:
n(X) = n(Z)
(1 p.)
Laskennallinen perustelu molekyylikaavalle, esimerkiksi:
Yhdisteiden X ja Z moolimassat riippuvat toisistaan seuraavasti:
M(X) = M(Z) + M(CO2) + M(C4H8) = M(Z) + 100,114 g/mol.
m(X) / M(X) = m(Z, saanto-% 100 %) / M(Z).
m(X) / (M(Z) + 100,114 g/mol) = m(Z, saanto-% 100 %) / M(Z)
M(Z) = m(Z, saanto-% 100 %) · 100,114 g/mol / (m(X) − m(Z, saanto-% 100 %))
= 1,5247191 g · 100,114 g/mol / (2,000 g − 1,5247191 g)
= 321,169 g/mol.
Ratkaistaan kuinka monta kertaa suhdekaava C₁₈H₂₇NO₄ esiintyy Z:n molekyylikaavassa vertaamalla Z:n ja suhdekaavan moolimassoja:
M(Z) = x · (C₁₈H₂₇NO₄) = 321,169 g/mol
x = M(C₁₈H₂₇NO₄) / M(Z) = 1
(4 p.)
- Kaikki erilaiset oikeat laskennalliset perustelut hyväksytään.
- Sanallista perustelua ilman laskuja ei hyväksytä.
Oikea vastaus:
Molekyylikaava on C₁₈H₂₇NO₄.
(1 p.)
9.2 Amiini Z liukenee huonosti veteen. Sen sijaan amiinin suola Y liukenee veteen paremmin. Siksi amiinin Z happo-emäsominaisuuksia tutkittiin liuottamalla 0,028 millimoolia amiinin suolaa Y veteen siten, että liuoksen lopputilavuus oli 0,100 l. Muodostuneen liuoksen pH oli 6,36. Laske amiinin Z emäsvakion arvo (t = 25 °C). 8 p.
c(Y) = n / V = 0,028 · 10⁻³ mol / 0,100 l) = 2,8 · 10⁻⁴ mol/l
(1 p.)
[H3O+] = 10–pH mol/l = 10–6,36 mol/l
(1 p.)
| BH⁺ | + | H₂O | ⇌ | B | + | H₃O⁺ | |
| alku (mol/l) | 2,8 · 10⁻⁴ | 0 | 0 | ||||
| tp (mol/l) | 2,8 · 10⁻⁴ − 10−6,36 | 10−6,36 | 10−6,36 |
(BH⁺ = yhdiste Y, B = yhdiste Z)
(2 p.)
- Taulukkoa ei vaadita, tilanne voi käydä ilmi oikeasta sijoituksesta happovakion lausekkeessa.
Lasketaan yhdisteen Y happovakion arvo:
Ka= [B][H₃O⁺] / [BH⁺] = (10−6,36)² / ((2,8 · 10⁻⁴ – 10−6,36)) = 6,8158 · 10⁻¹⁰.
(2 p.)
- Pelkästä happovakion kaavasta ei saa pistettä, vaan myös oikea sijoitus vaaditaan.
Lasketaan yhdisteen Z emäsvakion arvo yhdisteen Y happovakion avulla:
Kb = Kw/Ka
(1 p.)
= 1,008 · 10⁻¹⁴ / 6,8158 · 10⁻¹⁰ = 1,4789 · 10⁻⁵ ≈ 1,5 · 10⁻⁵ (1,48 · 10⁻⁵).
(1 p.)
- Jos käytetty arvo pKw = 14 tai Kw = 1,0 · 10⁻¹⁴, tulos on 1,47 · 10⁻⁵
- Tasapainovakiot ja niihin liittyvät lausekkeet hyväksytään yksiköillä ja ilman yksiköitä.
10. Pyykkikoneessa tapahtuvat reaktiot 20 p.
10.1 Vetyperoksidin vesiliuos hajoaa vedeksi ja happikaasuksi. Reaktiossa voidaan käyttää katalyyttinä kaliumjodidia. Ensimmäisessä vaiheessa jodidi-ionit hapettuvat vetyperoksidin avulla hypojodiitti-ioneiksi \mathrm{IO}^-. Toisessa vaiheessa hypojodiitti-ionit reagoivat vetyperoksidin kanssa tuottaen jodidi-ioneja, vettä ja happikaasua. Esitä tätä katalyyttistä reaktiota kuvaavat reaktioyhtälöt ja jodin hapetusasteet (hapetusluvut, hapetustilat) reaktion eri vaiheissa. 5 p.
H₂O₂(aq) + I⁻(aq) → H₂O (l) + IO⁻(aq)
IO⁻(aq) + H₂O₂(aq) → H₂O(l) + O₂(g) + I⁻(aq)
(3 p.)
- Oikeat aineet, varaukset ja kertoimet ensimmäisessä reaktioyhtälössä, 1 p. Oikeat aineet, varaukset ja kertoimet toisessa reaktioyhtälössä, 1 p. Kaikki olomuodot oikein molemmissa reaktioyhtälöissä, 1 p. Olomuotopisteet on sidottu oikeisiin aineisiin ja kertoimiin.
Hapetusasteet:
IO⁻: +1 tai +I
I⁻: –1 tai –I
(2 p.)
10.2 Aineistossa kuvataan katalyyttien toimintaperiaate pesuaineissa. Perustele, miksi pyykinpesuaineeseen lisättyjen katalyyttien avulla valkaiseva pesu voidaan tehdä alhaisemmassa lämpötilassa kuin valkaiseva pesu ilman katalyyttejä. Millaisia ominaisuuksia kuluttajakäyttöön myytävältä pyykinpesuaineeseen sopivalta katalyytiltä edellytetään? 5 p.
Katalyytti alentaa valkaisureaktion aktivoitumisenergiaa.
(2 p.)
- Jos mainittu, että katalyytti nopeuttaa reaktiota ilman mainintaa aktivoitumisenergiasta, 1 p.
Seuraavista ominaisuuksista maksimissaan 3 p.:
- edullinen hinta (1 p.)
- hyvä säilyvyys (1 p.)
- tehokkuus / nopeuttaa reaktiota hyvin / pieni määrä riittää / ei hajoa liian nopeasti käytössä tai eri lämpötiloissa / toimii käyttölämpötiloissa (1 p.)
- vesiliukoisuus (1 p.)
- käyttö on turvallista ympäristölle (1 p.)
- ei vahingoita käyttäjää, tekstiilejä tai pesukonetta (1 p.)
- katalyytin tuotanto on ympäristöystävällistä (1 p.)
- katalyytin raaka-aineet ovat saatavissa/riittävät/uusiutuvia/kierrätettäviä (1 p.)
10.3 Vetyperoksidi, natriumkarbonaatti ja TAED reagoivat vedessä, jolloin muodostuu DAED:a, peretikkahapon natriumsuolaa ja natriumvetykarbonaattia. Esitä tämän reaktion reaktioyhtälö ja piirrä vastaukseesi myös peretikkahapon natriumsuolan rakennekaava. Käytä apunasi aineistoja ja . Voit käyttää vastauksessasi lyhenteitä TAED ja DAED. 6 p.
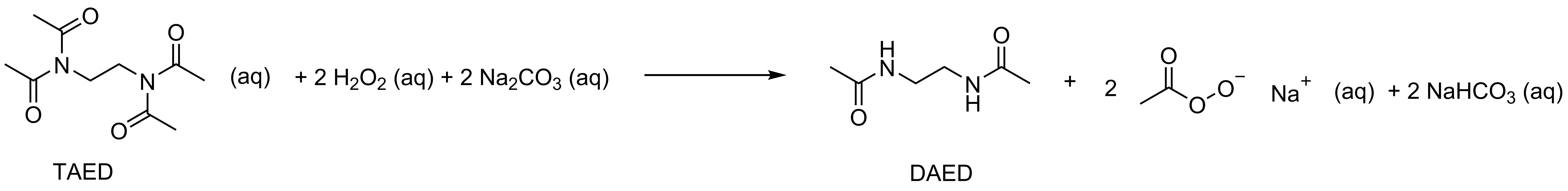 Kysytty reaktioyhtälö
Kysytty reaktioyhtälö
Reaktioyhtälö
(3 p.)
- Aineet oikein 1 p., kertoimet oikein 1 p. ja olomuodot oikein 1 p. Kertoimien ja olomuotojen pisteet on sidottu oikeisiin aineisiin. Jos reaktiossa on ylimääräinen tai puuttuva aine, 0 p. Väärät varaukset tulkitaan vääriksi aineiksi.
Peretikkahapon natriumsuolan rakennekaava
(3 p.)
10.4
Ketonit reagoivat happamassa liuoksessa vetyperoksidin kanssa, jolloin muodostuu rengasrakenteisia peroksideja. Osa näistä peroksideista on vaarallisen räjähdysherkkiä, mutta butan-2-onista muodostuvaa peroksidia, MEK-peroksidia, voidaan käyttää turvallisesti tyydyttymättömien yhdisteiden polymerointikatalyyttinä esimerkiksi lasikuituveneiden valmistuksessa.
MEK-peroksidin molekyylikaava on C₈H₁₆O₄, ja sen rakenteessa on kuuden atomin rengas. Esitä MEK-peroksidin rakennekaava, kun tiedetään, että se muodostuu butan-2-onin ja vetyperoksidin välisessä reaktiossa. Muodostumisreaktiossa O–O-sidokset eivät katkea.
4 p.
11. Fosfori ja Itämeri 20 p.
11.1
Itämeren pintaveden fosforipitoisuutta on seurattu pitkään. Vuonna 1958 fosforin pitoisuus pintavedessä oli 8,36 mikrogrammaa litraa kohden. Pintaveden fosforikonsentraatio (millimoolia kuutiometriä kohti) aikavälillä 1970–2018 on esitetty kuvaajassa .
Kuinka moninkertaiseksi pintaveden fosforipitoisuus kasvoi vuodesta 1958 vuoteen 2018? Perustele vastaus laskulla.
6 p.
Vuonna 1958 fosforin pitoisuus oli 8,36 · 10⁻⁶ g/l = 8,36 · 10⁻³ g/m³.
(1 p.)
Kuutiometrissä oli fosforia:
m(P) = 0,00836 g
n(P) = m(P)/M(P) = 0,00836 g / (30,97 g/mol) = 0,00026994 mol.
(1 p.)
Vuonna 2018 pitoisuus oli (luettuna kuvaajasta) noin 1,05 mmol/m³.
(2 p.)
- Arvot hyväksytään välillä 1,05 mmol/m³ – 1,15 mmol/m³.
Pitoisuuden (mmol/m³) kasvu 1,05 / 0,26994 = 3,8898,
(1 p.)
eli pitoisuus kasvoi noin 3,9-kertaiseksi.
(1 p.)
- Hyväksytään 3,89 – 4,26 -kertaiseksi. Myös sanallinen vastaus “noin nelinkertaiseksi” hyväksytään.
11.2
Tarkastele kuvaajaa , joka esittää maa-alueilta tulevien fosforipäästöjen määrää (eli fosforikuormitusta), hapettoman pohjan pinta-alaa sekä pintaveden fosforikonsentraatiota.
Kuvaile maa-alueilta tulevan fosforikuormituksen ja hapettoman pohjan pinta-alan muutoksia eri vuosikymmeninä. Arvioi näiden yhteyttä pintaveden fosforikonsentraatioihin.
7 p.
Havainnot hapettoman pohjan pinta-alasta, maksimissaan 2 p., 1 p. per kohta:
- 1970–2002 hapeton pinta-ala on vaihdellut paljon (0–35 000 km²), mutta palautunut aina lähelle nollaa.
- 2002–2007 hapettoman pinta-alan määrässä tapahtuu selvä kasvu (0 → 45 000)
- 2007–2018 hapettoman pinta-alan määrä asettunut (pysyvästi) aikaisempaa korkeammalle tasolle (ka. 15000 → ka. 45000)
- 1970–2002 trendilinja on vaakasuora tai hieman laskeva
- 2002–2018 trendilinja on kohoava
- 1970–2002 maksimi-minimi -vaihtelu on keskimäärin suurempaa (18 000 ± 18 000) kuin 2007–2018 (ka. 45 000 ± 10 000)
- 1970–2002 pinta-alan min/max vaihtelee n. 5–10 v sykleissä
- 2002–2018 pinta-alan min/max vaihtelee alle 5 v sykleissä
Havainnot maa-alueilta tulevasta kuormituksesta, maksimissaan 2 p., 1 p. per kohta:
- Maksimi- ja minimiarvot pysyvät saman vaihteluvälin sisällä koko tarkastelujaksolla (n. ±10 ∙ 10⁶ kg/vuosi min→max→min)
- 1970–1985 kuormitus kasvaa tasaisesti (näin vakioinen kasvu on epäluonnollista, joten kyseessä ehkä jonkinlainen ekstrapolointi)
- 1985–1995 kuormitus jatkaa kasvua
- 1970–1995 maa-alueilta tulevan fosforin määrä on kasvanut
- 1995–2015 maa-alueilta tulevan fosforin määrä on vähentynyt
- Maksimit ja minimit seuraavat toisiaan suurin piirtein samassa tahdissa koko tarkastelujaksolla (n. 2–3 vuoden syklit)
Pintaveden fosforikonsentraation yhteys hapettoman pohjan pinta-alaan ja maa-alueilta tulevaan kuormitukseen, maksimissaan 3 p., 1 p. per kohta:
- Yleisesti pintaveden fosforikonsentraatio ja hapettoman pohjapinta-alan suuruus korreloivat keskenään/kasvaa ja vähenee samaan tahtiin/muutokset seuraavat toisiaan.
- Yleisesti pintaveden fosforikonsentraatio ja maa-alueilta tuleva fosforipäästö eivät korreloi keskenään/kasva ja vähene samaan tahtiin/muutokset seuraavat toisiaan.
- 1970–1995 pintaveden fosforikonsentraatio on kasvanut samanaikaisesti maa-alueilta tulevan fosforikuormituksen kanssa. Samansuuntaisuus kuitenkin päättyy tähän.
- 1995–2015 pintaveden fosforikonsentraatio on kasvanut, vaikka maa-alueilta tuleva kuormitus on vähentynyt.
- Hapettoman pinta-alan maksimit ja minimit korreloivat lyhyelläkin aikavälillä kohtuullisen hyvin pintafosforin konsentraation maksimien ja minimien kanssa.
- Pintafosforin konsentraation muutos näyttäisi (jossain määrin) ennustavan hapettoman pinta-alan muutoksia, eikä päinvastoin.
11.3
Osa fosforista sitoutuu Itämeren pohjaan vivianiitti-mineraalina, Fe₃(PO₄)₂·8H₂O. Vastaavaa prosessia tutkitaan mahdollisena tapana saostaa fosfaattia jätevedenpuhdistamoissa Fe³⁺-ionien avulla.
Miksi Fe³⁺-ionien pitää ensin pelkistyä, jotta vivianiittia muodostuisi?
Mitä seurauksia on siitä, että fosforia ei kerätä talteen? Arvioi myös pitkän aikavälin seurauksia.
7 p.
Perustellaan raudan pelkistyminen:
Vivianiitissa rautaionien varaus on 2+ / raudan hapetusaste on +2, ja siksi Fe³⁺-ionien pitää ensin pelkistyä Fe²⁺-ioneiksi.
(2 p.)
Fosforin talteenoton tärkeys tuodaan ilmi ainakin kahdella eri näkökohdalla, joita perustellaan. Pisteitys: 1 p. / perusteltu seikka seuraavista vaihtoehdoista:
Fosforin huuhtoutuminen vesistöihin lisääntyy
- Vedenpuhdistusinfrastruktuurin vauriot lisääntyvät
- Rehevöityminen lisääntyy
- Metaanin/kasvihuonekaasujen määrä lisääntyy
- Happikato lisääntyy
- Sinilevien (syanobakteerien) määrä lisääntyy
- Fosfori varastoituu pohjasedimenttiin
- Veden laatu heikkenee
- Ekosysteemiin aiheutuu pysyviä muutoksia
- Ilmastonmuutos voimistuu
Kaivostoiminta lisääntyy
- Kustannukset kasvavat
- Energiantarve lisääntyy
- Saasteet lisääntyvät
- Virkistysalueet vähentyvät
- Kilpailu lisääntyy ja kovenee
- Energian hinnat nousevat
- Luonnon monimuotoisuus vähenee
- Eroosio lisääntyy
- Ilmastonmuutos voimistuu
Fosforin tarve kasvaa
- Kaivostoiminta lisääntyy
- Fosfori on uusiutumaton luonnonvara
- Fosfori ehtyy
Ruokaturva heikentyy
- Maatalouden häiriöt lisääntyvät
- Elintarvikkeiden hinnat nousevat
- Geopoliittiset jännitteet kasvavat
- Konfliktien uhka kasvaa
Jätteiden määrä kasvaa
- Jätteiden käsittely vaikeutuu tai se jätetään tekemättä, koska jätettä muodostuu enemmän kuin ehditään käsitellä
- Ekologiset vauriot lisääntyvät
- Ekosysteemi köyhtyy