Beskrivningar av goda svar: SV – Kemi
21.9.2023
Slutgiltiga beskrivningar av goda svar 9.11.2023
Grunderna enligt vilka bedömningen gjorts framkommer i de slutgiltiga beskrivningarna av goda svar. Uppgiften om hur bedömningsgrunderna tillämpats på examinandens provprestation utgörs av de poäng som examinanden fått för sin provprestation, de slutgiltiga beskrivningarna av goda svar och de föreskrifter gällande bedömningen som nämnden gett i sina föreskrifter och anvisningar. De slutgiltiga beskrivningarna av goda svar innehåller och beskriver inte nödvändigtvis alla godkända svarsalternativ eller alla godkända detaljer i ett godkänt svar. Eventuella bedömningsmarkeringar i provprestationerna anses vara jämställbara med anteckningar och sålunda ger de, eller avsaknaden av markeringar, inte direkta uppgifter om hur bedömningsgrunderna tillämpats på provprestationen.
Med studentexamensprovet utreds om studerandena tillägnat sig de kunskaper och färdigheter som anges i gymnasiets läroplan och uppnått tillräcklig mognad enligt målen för gymnasieutbildningen. Målet för bedömningen i läroämnet kemi är en förståelse för och en tillämpning av den kemiska kunskapen. Vid bedömningen beaktas även de färdigheter med vilka man tillägnar sig experimentell kunskap och förmågan att behandla den. Till sådan kunskap hör till exempel planering av experiment, trygg hantering av arbetsredskap och reagens, presentation och tolkning av resultat samt förmågan att dra slutsatser och tillämpa dem.
Vid bedömningen av uppgifterna i kemi läggs vikten vid ett framställningssätt som betonar läroämnets karaktär och vid precision i begreppen och språkbruket. Reaktionsformlerna ställs upp utan oxidationstal med minsta möjliga heltalskoefficienter och med aggregationstillstånden angivna. I organiska reaktionslikheter används strukturformler, men aggregationstillstånd krävs inte. Olika sätt att skriva strukturformler godkänns.
I beräkningsuppgifter ska storhetsekvationer och formler användas på ett sätt som visar att examinanden förstått uppgiften rätt och tillämpat korrekt princip eller lag i sin lösning. Av svaret framgår entydigt hur man når slutresultatet, men omfattande mellansteg behövs inte. CAS-program kan utnyttjas i uppgiftens olika skeden. De principer och lagar som gäller den aktuella situationen samt uppgiftens slutresultat och de slutsatser som dras utgående från lösningen är av central betydelse och ska framgå av svaret. Slutresultaten ges med enheter och med den noggrannhet som utgångsvärdena kräver, och slutsatserna motiveras.
Mätresultat och grafer som ritats utgående från dessa utnyttjas vid analysen av data och då man drar slutsatser. Till mätpunkterna anpassas en vederbörlig rät linje. Värden som ligger mellan mätpunkterna kan interpoleras med ögonmått genom visuell avläsning av grafen eller med hjälp av ett lämpligt program. Axlarnas namn, enheter och skala märks ut i grafen. I grafen anges sådana punkter som är väsentliga för slutsatserna, som ekvivalenspunkten för en titrerkurva eller tangenten som används när man beräknar en hastighet vid en given tidpunkt.
I essäsvar och förklarande svar kompletteras texten med reaktionsformler, ekvationer eller teckningar. Fenomenen som behandlas beskrivs på makroskopisk, mikroskopisk och symbolisk nivå. Av svaret framgår att det material som hör ihop med uppgiften har använts, tillämpats, analyserats och utvärderats i enlighet med uppgiftsformuleringen. Ett svar på god nivå är välstrukturerat och innehållsmässigt konsekvent.
Svaren bedöms enligt de kriterier som gäller för respektive uppgift. Utgångspunkten vid bedömningen är de förtjänster för vilka poäng ansamlas. Om en central kemisk princip saknas eller är felaktig avslutas poängansamlingen. Då godkänns inte fortplantning av det felaktiga resultatet (ej-FF). Exempel på sådana fel är stökiometrifel, fel begränsande faktor samt fel ämne i en reaktionslikhet. För övriga brister eller fel godkänns fortplantning av det felaktiga resultatet (FF), och då fortsätter ansamlingen av poäng efter bristfälligheten eller felet. I de krävande uppgifterna i provets del 3 förutsätts en större precision i behandlingen av principer än i de grundläggande uppgifterna i början av provet. Ur kemisk synvinkel inexakt språkbruk, små räknefel eller slarvig användning av närmevärden orsakar avdrag på 0–3 p. till exempel på följande sätt:
- avrundnings- och kopieringsfel som inte påverkar slutresultatet, −0 p.
- kopieringsfel, avrundningsfel och små slarvfel som påverkar slutresultatet, ett enskilt litet fel i en strukturformel, −1 p.
- enhetsomvandlingsfel, systematiska fel i en strukturformel samt övriga fel som till sin natur är allvarligare än små fel, men där det ändå inte är fråga om en felaktig kemisk princip, −2 p.
22.9.2023 korrigerat skrivfel i deluppgifterna 4.1 och 5.2 samt en enhet i deluppgift 8.2.
10.11.2023 kl. 9.30 ekvation samt poängtal som saknades i deluppgift 9.2 tillagda.
Del 1: 20-poängsuppgift
1. Flervalsuppgifter från kemins olika delområden 20 p.
1.1 Vilket av följande är ett rent ämne? 2 p.
- sackaros (2 p.)
1.2 Vilken av följande omständigheter har den största inverkan på hur lätt ett rent ämne avdunstar? 2 p.
- hur starka bindningarna mellan molekylerna är (2 p.)
1.3 Vilket av följande påståenden om extraktion är felaktigt? 2 p.
- I extraktion använder man en rörlig fas. (2 p.)
1.4 UV-VIS-spektroskopi grundar sig på synligt ljus och strålning inom det ultravioletta området. Vilket fenomen utgår UV-VIS-spektroskopin från? 2 p.
- excitationer mellan elektronernas energinivåer (2 p.)
1.5 Följande atomer eller joner har samma antal elektroner. Vilken atom eller jon har den minsta radien? 2 p.
- \mathrm{K}^{+} (2 p.)
1.6 Vilken av följande föreningar uppvisar enantiomeri (spegelbildsisomeri, alltså optisk aktivitet)? 2 p.
-
(2 p.)
1.7 Vilket av följande påståenden om plaster är felaktigt? 2 p.
- Härdplaster har en exakt smältpunkt. (2 p.)
1.8 Vilken av följande föreningar har den högsta kokpunkten? 2 p.
- propan-1-ol (2 p.)
1.9 Vilken av följande föreningar har den största lösligheten i vatten vid rumstemperatur? 2 p.
- NH₃(g) (2 p.)
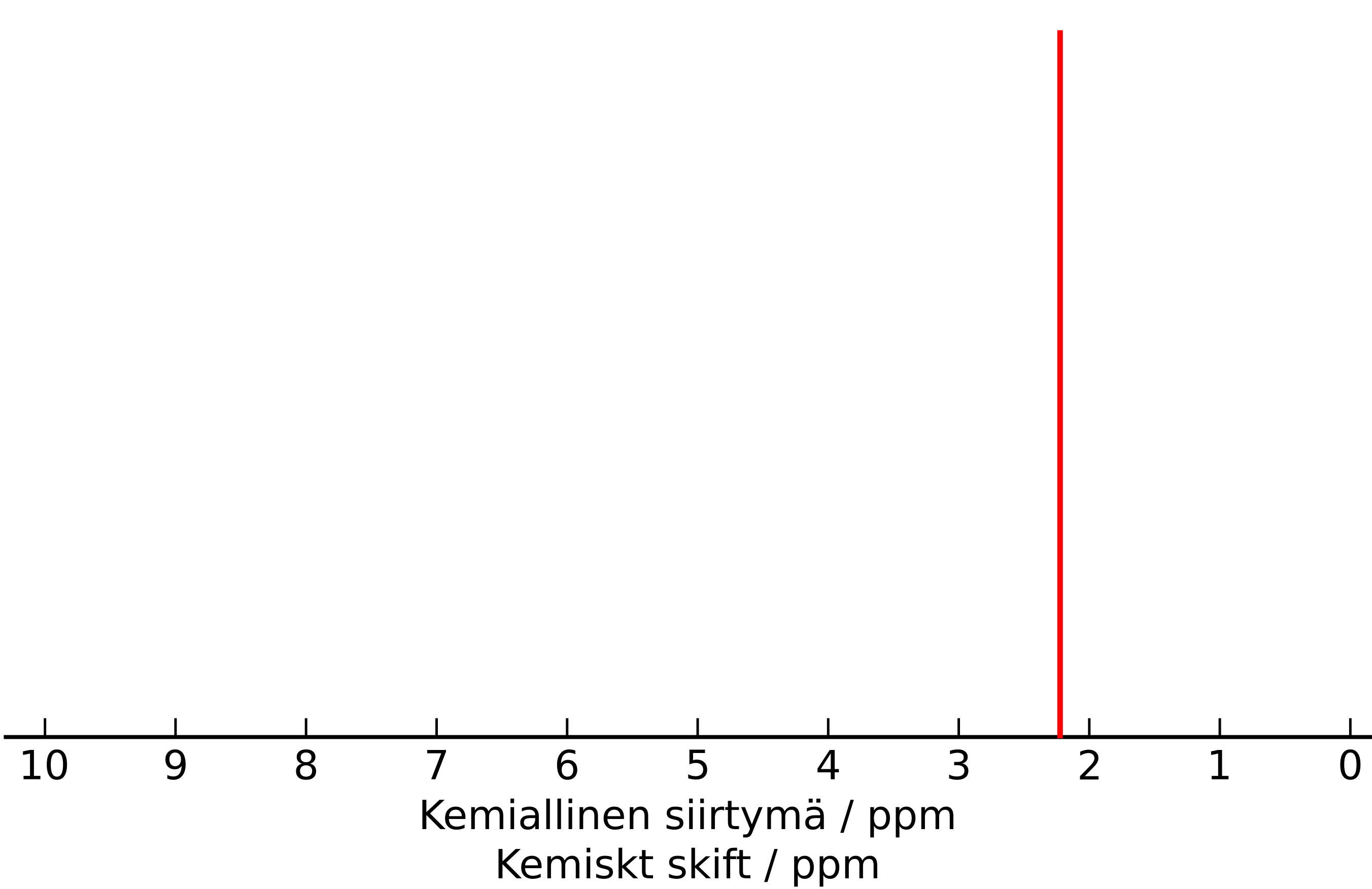
1.10 Man bestämde molekylformeln för en färglös vätskeformad förening till C₃H₆O. Man mätte föreningens 1H-NMR-spektrum som visas nedan. Vilken förening är det fråga om? 2 p.
-
 (2 p.)
(2 p.)
Del 2: 15-poängsuppgifter
2. Termitreaktion 15 p.
Fe₂O₃(s) + 2Al(s) → 2Fe(l) + Al₂O₃(s).
2.1 Den här termitreaktionen undersöktes i ett visst laboratorieexperiment. Man använde 3,85 g aluminium och 10,2 g järn(III)oxid som utgångsämnen. Hur många gram järn bildades? 9 p.
n(Al) = m(Al) / M(Al) = 3,85 g / (26,98 g/mol) = 0,14270 mol
(1 p.)
och
n(Fe₂O₃) = m(Fe₂O₃) / M(Fe₂O₃) = 10,2 g / (159,70 g/mol) = 0,063870 mol.
(1 p.)
Bestämning och motivering av den begränsande faktorn, till exempel:
Enligt reaktionsformeln reagerar 2 mol aluminium och 1 mol järn(III)oxid med varandra, och substansmängden för järnoxid som då behövs är n(Fe₂O₃) = 0,5 · n(Al) = 0,5 · 0,14270 mol = 0,071350 mol. Eftersom det finns mindre järnoxid än det här till förfogande är järnoxid den begränsande faktorn.
(3 p.)
- Den begränsande faktorn har motiverats, 2 p. Rätt begränsande faktor har valts, 1 p. Den senare poängen är bunden till att båda substansmängderna har beräknats.
- Om den begränsande faktorn har valts fel på grund av ett litet slarvfel görs ett poängavdrag på grund av slarvfelet och därtill förloras poängen för stökiometriförhållandet, men övriga poäng kan ansamlas. Om den begränsande faktorn valts fel av någon annan orsak avslutas poängansamlingen.
n(Fe) = 2 · n(Fe₂O₃) = 2 · 0,063870 mol = 0,12774 mol
(2 p.)
- Om stökiometrin är felaktig avslutas poängansamlingen.
m(Fe) = n(Fe) · M(Fe) = 0,12774 mol · 55,85 g/mol = 7,1343 g
(1 p.)
Svar: Det bildades 7,13 g (7,1 g eller 7,134 g) järn.
(1 p.)
2.2 Är reaktionen en reduktions-oxidationsreaktion (redox-reaktion)? Motivera ditt svar. 3 p.
Reaktionen är en reduktions-oxidationsreaktion/redoxreaktion.
(1 p.)
I utgångsämnena är järnets oxidationstal +3 och i produkterna är det 0.
(1 p.)
Aluminium har oxidationstalet 0 i utgångsämnena och +3 i produkterna.
(1 p.)
ELLER
I utgångsämnena är aluminium i grundämnesform och i produkterna är aluminium i jonform.
(1 p.)
Järn är i jonform i utgångsämnena och i grundämnesform i produkterna.
(1 p.)
- Om svaret enbart är att aluminium oxideras och järn reduceras erhålls 1 p. för motiveringen.
2.3 Är reaktionen endoterm eller exoterm? Motivera ditt svar. 3 p.
Reaktionen är exoterm (1 p.) för det frigörs värmeenergi i reaktionen (1 p.).
Motivering, till exempel:
Det kan man se utifrån att järnet smälter i reaktionen / järnets aggregationstillstånd är vätska (l) i produkterna. (1 p.)
ELLER
För att termitreaktionen frigör värme. (1 p.)
- Svaret kan också motiveras med hjälp av en beräkning utifrån bildningsentalpierna (som ändå är felaktig om man inte har använt bildningsentalpin för vätskeformigt järn), om talvärdet som erhålls är –847,8 kJ/mol eller –848 kJ/mol eller –850 kJ/mol
3. Okända ämnen 15 p.
3.1
Förening X är ett vitt pulver som reagerar med vätekloridsyra. I reaktionen avges gas.
Med hjälp av atomabsorptionsspektroskopi kunde man påvisa att X innehöll kalciumjoner men inte övriga metaller.
Molmassan för förening X bestämdes till ca 100 g/mol men man kunde inte bestämma molmassan exakt.
En termogravimetrisk analys visade att det avgick gas då man upphettade förening X. Man kunde identifiera gasen som koldioxid. Efter upphettningen blev det kvar ett pulver Y som var lite mörkare till färgen. Reaktionen för upphettningen kan alltså skrivas så här: X → Y + CO₂(g).
Pulvret Y löste sig dåligt i vatten men det bildade en vattenlösning som var klart basisk.
Namnge föreningarna X och Y. Skriv reaktionsformeln (reaktionslikheten) för reaktionen mellan förening Y och vatten.
7 p.
Förening X är kalciumkarbonat/CaCO₃.
(2 p.)
Förening Y är kalciumoxid/CaO.
(2 p.)
- Namnen kalk eller kalciumvätekarbonat godkänns inte.
Reaktionen mellan förening Y och vatten:
CaO(s) + H₂O(l) → Ca(OH)₂(aq/s)
(3 p.)
- Rätt ämnen, 1 p., rätt koefficienter, 1 p., och rätt aggregationstillstånd, 1 p. Koefficienternas och aggregationstillståndens poäng är bundna till rätt ämnen. Om ämnen saknas eller är överlopps, 0 p. Felaktiga laddningar tolkas som att ämnet är fel.
3.2
Förening P är en färglös vätska. Utifrån en grundämnesanalys består P av väte, kol och syre.
Man mätte masspektret för P. Masspektret visas i material .
En vattenlösning av P upphettades i en reaktor. Med hjälp av kromatografi bestämde man att det genom en jämviktsreaktion bildades två andra föreningar, Q och R, i vattenlösningen. Under reaktionen blev vattenlösningen något sur. Via vidare experiment kunde man dra slutsatsen att Q är en alkohol.
Namnge föreningarna P, Q och R eller rita dessas strukturformler. Till vilka föreningsklasser hör föreningarna P och R?
8 p.
Förening P är metylformiat/metylmetanat.
(2 p.)
Förening Q är metanol och
(2 p.)
förening R är metansyra/myrsyra.
(2 p.)
- Om både namn och struktur har givits i svaret måste både vara rätt.
P är en ester
(1 p.)
och R är en karboxylsyra.
(1 p.)
Strukturformlerna
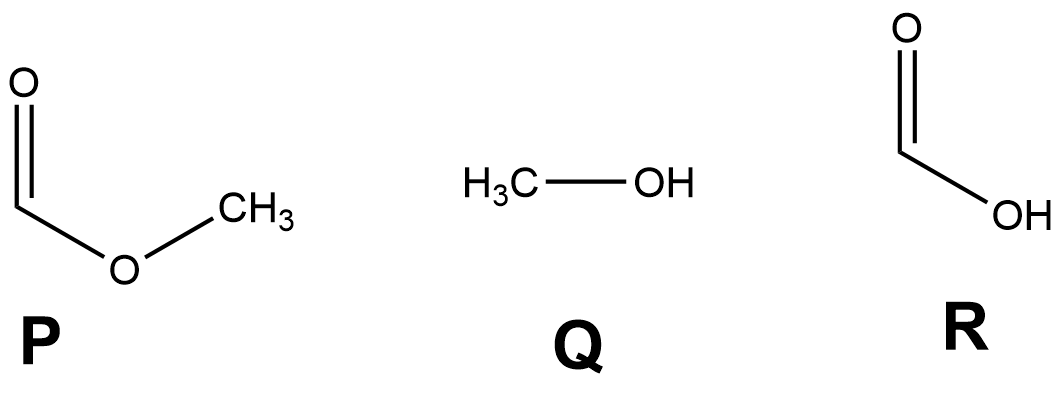 Strukturformlerna för föreningarna P, Q och R
Strukturformlerna för föreningarna P, Q och R
4. Syntes av ett läkemedel 15 p.
Haloperidol är ett läkemedel som används för att vårda schizofreni och bipolär sjukdom. Material visar mellanprodukten R1 som bildas under syntesen, och hela syntesrutten som omfattar tre steg visas i form av ett syntesschema i material . Inom industrin utförs varje skede av syntesen för sig och mellanprodukterna separeras.
Studera material och och utför deluppgifterna 4.1–4.4.
4.1 Man framställde haloperidol i en fabrik och hade till sitt förfogande 6,44 kg av mellanprodukten R1 (C₁₁H₁₄Br₂ClN). Man kunde isolera 3,06 kg av mellanprodukt S ur reaktionen i skede 2. Räkna ut det procentuella utbytet för skede 2. 6 p.
n(R1) = m(R1) / M(R1) = 6 440 g / (355,482 g/mol) = 18,1162 mol
och
n(S) = m(S) / M(S) = 3 060 g / (211,682 g/mol) = 14,4556 mol.
(3 p.)
- Molmassan för R är rätt, 1 p., molmassan för S är rätt, 1 p., båda substansmängderna är rätt, 1 p.
Det procentuella utbytet = 14,4556 mol / 18,1162 mol
(1 p.)
= 79,7938 %.
(1 p.)
Svar: Det procentuella utbytet är 79,8 % (80 % eller 79,79 %).
(1 p.)
4.2 Balansera reaktionsformeln (reaktionslikheten) i skede 2. Du kan använda bokstavssymbolerna R1 och S i ditt svar. 2 p.
R1 + 2NaOH(aq) ⇌ S + 2NaBr(aq) + H₂O(l)
(2 p.)
- I svaret framgår att det bildas vatten i reaktionen, 1 p. Rätt reaktionsformel, 1 p.
- I den här deluppgiften beaktas undantagsvis inte aggregationstillstånden i poängsättningen.
4.3 Rita strukturen för utgångsämne P. 4 p.
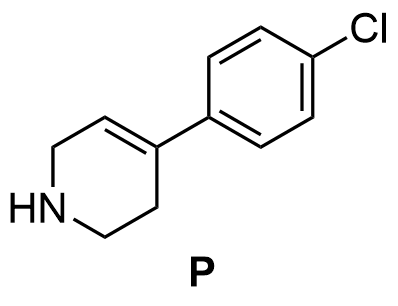 Strukturformeln för förening P
Strukturformeln för förening P
Dubbelbindningen är utritad på rätt plats.
(2 p.)
Aminogruppen är utritad på rätt plats och har rätt protoneringsgrad.
(2 p.)
- Molekylens stam måste vara rätt för att poängen ska ansamlas.
- Om kväveatomen saknas, 0 p. för strukturen
- Överlopps heteroatomer som binder till molekylstammen, −2 p. per atom. Om en bromatom är bunden vid samma ställe som i föreningarna R1 och R2 förloras dock enbart dubbelbindningspoängen.
4.4 R1 och R2 är isomerer. Vilket slag av isomeri är det fråga om? Motivera varför det i skede 1 huvudsakligen bildades isomer R1 medan det i praktiken inte alls bildades isomer R2. 3 p.
R1 och R2 är sinsemellan ställningsisomerer.
(1 p.)
Det bildas mer av isomer R1, för additionsreaktionen följer Markovnikovs regel: väteatomen binds till den kolatom som redan binder till flera väteatomer.
(2 p.)
- Poängen för Markovnikovs regel erhålls inte om dubbelbindningen inte har ritats ut på rätt ställe i deluppgift 4.3.
5. Elektrolys 15 p.
5.1 Vilket grundämne oxideras och vilket reduceras då man elektrolyserar en smälta av magnesiumklorid? Skriv reaktionsformlerna (reaktionslikheterna) för oxidations- och reduktionsreaktionerna. 5 p.
Klor oxideras och magnesium reduceras.
(1 p.)
2Cl⁻ → Cl₂ + 2e⁻
(2 p.)
Mg²⁺ + 2e⁻ → Mg
(2 p.)
- Aggregationstillstånden krävs inte men om de är fel (t.ex. Cl⁻(aq) och Mg²⁺(aq)), tas ett poängavdrag −1 p. en gång.
- Om ämnen saknas eller är överlopps, 0 p. Felaktiga laddningar tolkas som att ämnet är fel.
5.2 Vilka oxidations- och reduktionsreaktioner sker då man vid temperaturen 25 °C elektrolyserar en vattenlösning av litiumjodid som har koncentrationen 1,0 mol/l? Skriv reaktionsformlerna och motivera varför de här reaktionerna sker. 6 p.
Svaret motiveras med de oxidations- och reduktionsreaktioner som sker.
Följande oxidationsreaktioner är möjliga:
2I⁻ → I₂ + 2e⁻, E = −0,54 V
(1 p.)
2H₂O → O₂ + 4H⁺ + 4e⁻, E = −1,23 V
(1 p.)
- Varje felaktig reaktionsformel upphäver poängen för en korrekt reaktionsformel.
- Normalpotentialvärdena krävs inte för reaktionsformelpoängen, men de krävs för motiveringspoängen.
Normalpotentialvärdet är större för jods oxidationsreaktion, så den sker.
(1 p.)
- Den här poängen är bunden till att rätt reaktioner har behandlats (båda reaktionerna måste vara rätt).
Följande reduktionsreaktioner är möjliga:
Li⁺ + e⁻ → Li, E = −3,04 V
(1 p.)
2H₂O + 2e⁻ → H₂ + 2OH⁻, E = −0,83 V
(1 p.)
- Varje felaktig reaktionsformel upphäver poängen för en korrekt reaktionsformel.
- Normalpotentialvärdena krävs inte för reaktionsformelpoängen, men de krävs för motiveringspoängen.
Normalpotentialvärdet är större för vattnets reduktionsreaktion, så den sker.
(1 p.)
- Den här poängen är bunden till att rätt reaktioner har behandlats (båda reaktionerna måste vara rätt).
- Om termerna oxidation och reduktion är använda tvärtom, −2 p.
- I svaret krävs endast reaktionsformlerna för jods oxidationsreaktion och för vattnets reduktionsreaktion. Oxidation av vatten och reduktion av litium kan beskrivas med ord.
5.3 Vid produktionen av zink rengörs zinken genom elektrolys av en vattenlösning av zinksulfat. Varför måste man ändå framställa magnesium genom att elektrolysera en smälta av magnesiumklorid och inte en vattenlösning av magnesiumklorid? 4 p.
Man måste elektrolysera magnesiumklorid som smälta, för i en vattenlösning skulle vatten oxideras och reduceras.
(2 p.)
Motivering:
Normalpotentialvärdet är större/mer positivt för vattnets reduktionsreaktion än för magnesiumjonens reduktionsreaktion.
(2 p.)
- Jämförelse av reduktionspotentialerna för vatten och magnesium, 1 p. Slutsatsen att den reaktionen som har ett större normalpotentialvärde sker, 1 p.
- Talvärden krävs inte i motiveringen.
6. Upplösning 15 p.
6.1 Vilka observationer kan du göra när det gäller upplösningsprocesserna i videorna och och vilka slutsatser kan du dra om processerna? Motivera dina slutsatser. 6 p.
Högst 6 p. ansamlas av följande:
Observationer:
I början eller i slutet är temperaturen jämn i båda kärlen.
ELLER
Temperaturen i början och i slutet har antecknats för båda videorna.
(1 p.)
Då man häller CaCl₂ i kärlet stiger temperaturen.
(1 p.)
Då man häller NH₄Cl i kärlet sjunker temperaturen.
(1 p.)
Slutsatser:
Det sker ingen värmeöverföring till/från omgivningen.
(2 p.)
Upplösningen av CaCl₂ är en exoterm process / frigör värmeenergi.
(2 p.)
Upplösningen av NH₄Cl är en endoterm process / binder värmeenergi.
(2 p.)
6.2
Vi betraktar upplösningen av kalciumklorid i video . Vilka bindningar brister och vilka bindningar bildas i processen som sker på videon? Namnge bindningstyperna.
I vilka av de här processerna frigörs energi och i vilka binds energi? Vad är det som bestämmer om upplösningen är en endoterm eller en exoterm process?
9 p.
Följande ger högst 4 p.:
Jonbindningen mellan Ca²⁺- och Cl⁻-jonerna
(1 p.)
och vätebindningarna mellan vattenmolekyler
(1 p.)
- Ovanstående poäng förutsätter att bindningen har namngivits rätt och identifierats mellan de rätta jonerna eller molekylerna.
- Varje felaktig bindningssort upphäver poängen för en bindning av rätt sort.
- Om jonbindningen i CaCl₂ påstås finnas mellan grundämnen, atomer eller molekyler, eller om kloridjonen ersatts av klorjon, 0 p. för jonbindningen, men följande bundna poäng kan erhållas.
brister,
(1 p.)
- poängen är bunden till någondera av bindningspoängen ovan.
och då binds energi.
ELLER
Processen då en bindning brister är endoterm.
(1 p.)
- poängen är bunden till poängen som ges för att bindningen brister.
Följande ger högst 3 p.:
Jon-dipolbindningar mellan Ca²⁺- respektive Cl⁻-jonerna och vattenmolekylerna
(1 p.)
- Ovanstående poäng kräver att bindningen har namngivits rätt och identifierats mellan de rätta jonerna och molekylerna.
- Varje felaktig bindningssort upphäver poängen för en bindning av rätt sort.
bildas
(1 p.)
- Poängen är bunden till poängen för jon-dipolbindningen.
och då frigörs energi.
ELLER
Processen då en bindning bildas är exoterm.
(1 p.)
- Poängen är bunden till poängen för att bindningen bildas.
Analys gällande huruvida processen är endoterm eller exoterm:
Processen är exoterm om totalenergin för de nya bindningarna som bildas (räknas som bindningsenergin gånger antalet bindningar) är större än totalenergin för bindningarna som brister (räknas som bindningsenergin gånger antalet bindningar).
ELLER
Processen är endoterm om totalenergin för de nya bindningarna som bildas (räknas som bindningsenergin gånger antalet bindningar) är mindre än totalenergin för bindningarna som brister (räknas som bindningsenergin gånger antalet bindningar).
(3 p.)
- Energin som binds då bindningar bryts och som frigörs då bindningar bildas har jämförts, 2 p. Rätt slutsats har dragits gällande om reaktionen är exoterm eller endoterm, 1 p. Slutsatspoängen är bunden till att motiveringen är rätt.
7. Titrering av underklorsyrlighet 15 p.
7.1
En studerande ville bestämma den exakta koncentrationen för en underklorsyrlighetslösning (HClO) som förvarats i ett laboratorium. Hen beslutade att utföra bestämningen genom titrering. För titreringen framställde hen en natriumhydroxidlösning genom att lösa upp 4,535 g natriumhydroxidkorn i vatten så att lösningens slutvolym var 1 000,0 ml. Vi antar att natriumhydroxidkornen var vattenfria. Studeranden överförde 10 ml av underklorsyrlighetslösningen som skulle undersökas med fyllpipett till en erlenmeyerkolv och tillsatte några droppar indikatorlösning. Under titreringen gick det åt 18,1 ml natriumhydroxidlösning. Syrakonstanten Kₐ för underklorsyrlighet är 3{,}0\cdot 10^{-8} mol/l.
Skriv reaktionsformeln (reaktionslikheten) för titreringsreaktionen som sker i studerandens experiment.
Vilken var koncentrationen för underklorsyrlighetslösningen?
9 p.
Reaktionsformel: HClO(aq) + NaOH(aq) → ClONa(aq) + H₂O(l)
(3 p.)
- Rätt ämnen, 1 p., rätt koefficienter, 1 p., och rätt aggregationstillstånd, 1 p. Koefficienternas och aggregationstillståndens poäng är bundna till rätt ämnen. Om ämnen saknas eller är överlopps, 0 p. Felaktiga laddningar tolkas som att ämnet är fel.
- Olika sätt att skriva natriumkloratets formel godkänns under förutsättning att symbolerna för klor och syre kommer efter varandra i formeln.
Substansmängden för natriumhydroxid och koncentrationen för lösningen som framställs:
n(uppvägd NaOH) = m/M = 4,535 g / (39,998 g/mol) = 0,11338 mol
(1 p.)
c(NaOH-lösning) = n/V = 0,11338 mol / (1,000 l) = 0,11338 mol/l.
(1 p.)
n(NaOH-förbrukning) = c · V = 0,11338 mol/l · 18,1 · 10⁻³ l = 2,0522 · 10⁻³ mol
(1 p.)
Enligt reaktionsformeln är n(HClO) = n(NaOH)
(1 p.)
- Om stökiometrin är fel i reaktionsformeln erhålls inte den här poängen och inte heller de följande poängen.
Koncentrationen för underklorsyrlighetslösningen:
c(HClO) = n/V = 2,0522 · 10⁻³ mol / (10,0 · 10⁻³ l) = 0,20522 mol/l
(1 p.)
Svar: Koncentrationen för underklorsyrlighetslösningen var 0,205 mol/l (0,2052 mol/l eller 0,21 mol/l).
(1 p.)
7.2
Underklorsyrlighetens koncentration förändras under förvaringen, eftersom HClO-molekylen långsamt sönderfaller. Då bildas två produkter. Den ena produkten är syrgas och den andra produkten reagerar med vatten.
Skriv reaktionsformeln för sönderfallet av underklorsyrlighet.
Förändras lösningens pH under förvaringen? Motivera ditt svar.
6 p.
Reaktionsformeln: 2HClO(aq) → 2HCl(aq/g) + O₂(g/aq)
(3 p.)
- Rätt ämnen, 1 p., rätt koefficienter, 1 p., och rätt aggregationstillstånd, 1 p. Koefficienternas och aggregationstillståndens poäng är bundna till rätt ämnen. Om ämnen saknas eller är överlopps, 0 p. Felaktiga laddningar tolkas som att ämnet är fel.
pH-värdet förändras.
(1 p.)
- Den här poängen erhålls även om förändringen av pH skulle ha förklarats fel och/eller förändringen är mot fel håll.
HCl som bildas är en stark syra. Nästan alla dess molekyler avger en proton.
(1 p.)
- Den här motiveringen kan också formuleras med en reaktionsformel.
Därför minskar lösningens pH-värde / Därför ökar lösningens surhet.
(1 p.)
- Poängen är bunden till rätt motivering.
8. Bestämning av fluoridjonhalten i vatten 15 p.
Det finns vanligen mycket små mängder av fluoridjoner i vattendragen i Finland, med undantag för rapakiviområden där fluoridhalten i grundvattnet kan vara flera milligram per liter. Fluorid förhindrar bland annat att det bildas hål i tänderna, men ett för stort intag av fluorid har en skadlig inverkan på hälsan. Därför är gränsvärdet för fluoridhalten i hushållsvatten 1,5 mg/l.
Man kan bestämma fluoridjonhalten i vatten med en fluoridjonelektrod som selektivt kan detektera fluoridjoner. Elektroden anger mätresultatet som en elektrisk potential med enheten millivolt. Då fluoridjonhalten i provet blir större blir den elektriska potentialen mindre.
8.1 För bestämningen av fluoridjonhalten i brunnsvatten framställde man en baslösning av natriumfluorid som hade fluoridjonhalten 100,0 mg/l i en 1 000 ml mätkolv. Hur många gram natriumfluorid måste man väga upp? 5 p.
I en 1 000 ml mätkolv behöver man 100,0 mg fluoridjoner. Vi beräknar motsvarande substansmängd:
n(F⁻) = m / M = 0,1000 g / (19,00 g/mol) = 0,00526316 mol.
(1 p.)
Vi beräknar substansmängden och massan för natriumfluorid:
n(F⁻) = n(NaF)
(2 p.)
M(NaF) = 41,99 g/mol
m(NaF) = n(NaF) · M(NaF) = 0,00526316 mol · 41,99 g/mol = 0,22100 g
(1 p.)
= 0,2210 g (0,221 g eller 0,22100 g)
(1 p.)
8.2 En baslösning hade fluoridjonhalten 100,0 mg/l. Man framställde en arbetslösning i en annan mätkolv genom att späda ut baslösningen. Fluoridjonhalten i arbetslösningen var 10,0 mg/l och mätkolvens volym var 50 ml. Hur mycket av baslösningen måste man pipettera? 4 p.
Massan som ska pipetteras till arbetslösningen beräknas genom att arbetslösningens halt (mg/l) multipliceras med volymen (ml):
m = c · V
(1 p.)
- Om densiteten diskuteras istället för koncentrationen eller halten, eller om densitetens symbol ρ har använts, 0 p. för storhetsekvationen.
= 10,0 (mg/l) · 0,0500 l = 0,500 mg.
(1 p.)
Volymen för baslösningen som ska pipetteras beräknas genom att massan (mg) som ska pipetteras divideras med halten (mg/l) för baslösningen:
V = 0,500 mg / (100,0 mg/l)
(1 p.)
= 0,00500 l = 5,00 ml (5 ml eller 5,0 ml eller 5,000 ml).
(1 p.)
- Uppgiften kan också lösas med hjälp av ekvationen carbetslösningVarbetslösning = cbaslösningVbaslösning, så att enheterna för koncentration i beräkningen är mg/l eller mol/l. Då följer poängsättningen modellen: storhetsekvationen 1 p., beräkningen 2 p., svaret 1 p.
8.3
Man framställde standardlösningar genom att utspäda arbetslösningen. För en mätning av ett brunnsvattenprov pipetterades 25,0 ml prov och 25,0 ml buffertlösning i ett dekanterglas. Var och en av standardlösningarna samt det buffrade vattenprovet analyserades med en fluoridjondetektor. Resultaten visas i material . I tabellens andra spalt har man beräknat tiologaritmen av haltens värde för att kunna avläsa brunnsvattenprovet från standardlinjen. (En graf av E som en funktion av halten är inte en rät linje. Däremot erhåller man en rät linje då E framställs som en funktion av logaritmen av halten.)
Rita en standardlinje utifrån materialet och bestäm linjens ekvation. Anteckna E(mV) på den lodräta axeln och lg(halt/(mg/l)) på den vågräta axeln. Bestäm fluoridjonhalten för brunnsvattenprovet med hjälp av ekvationen för linjen.
6 p.
Grafen skapad med Geogebra:
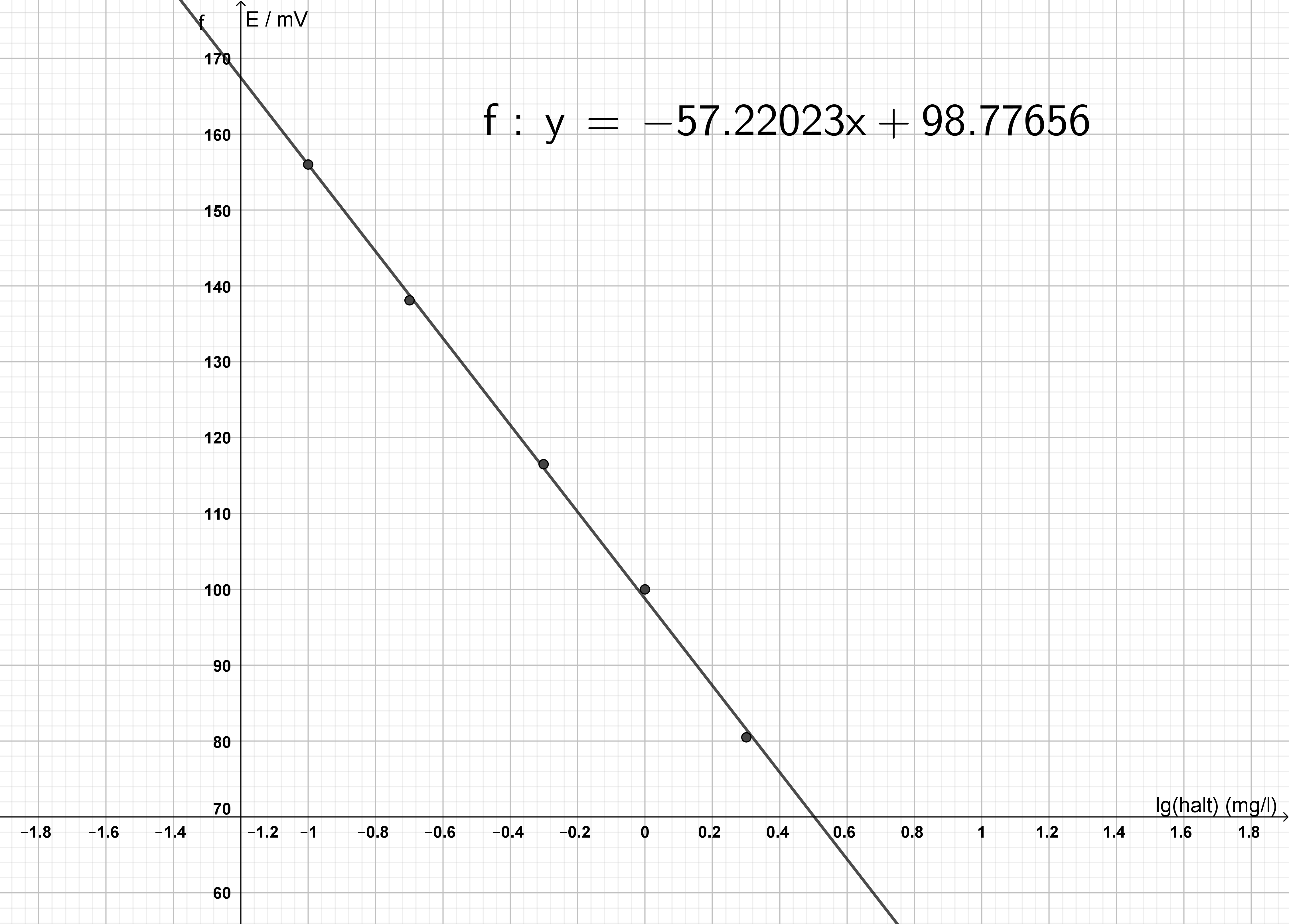 Exempel på en graf som kan produceras i svaret.
Exempel på en graf som kan produceras i svaret.
Linjens ekvation: y = −57,22023x + 98,77656.
(2 p.)
- Insättning av mätpunkterna på rätt sätt eller rätt linje utritad, 1 p. Linjens ekvation, 1 p.
- Om en exponentialfunktion eller annan högre ordningens funktion har anpassats till mätpunkterna avslutas poängansamlingen.
(Enheterna har för klarhetens skull utelämnats.)
Mätresultatet för provet avläses ur tabellen: 90,6 mV.
x erhålls direkt ur linjens ekvation: 0,142896 mg/l.
(1 p.)
lg(halt/(mg/l)) = 0,142896
och vi får
halten: 100,142896 mg/l = 1,3896 mg/l.
(1 p.)
Den verkliga halten är två gånger större för att man tillsatte en lika stor volym av buffertlösning som man hade av brunnsvattenprovet.
(1 p.)
Den verkliga halten är alltså 2,78 mg/l (2,8 mg/l eller 2,779 mg/l).
(1 p.)
Del 3: 20-poängsuppgifter
9. Syntes av en amin 20 p.
9.1 Man använde 2,000 gram av förening X för syntesen och erhöll 1,357 g av aminen Z som produkt. Det procentuella utbytet var 89 %. En grundämnesanalys av aminen Z visade att föreningens sammansättning i massprocent var följande: C 67,26 %, H 8,47 %, N 4,36 %, O 19,91 %. Vilken är molekylformeln för aminen Z? 12 p.
Beräkning av proportionsformeln:
Hundra gram av föreningen innehåller
m(C) = 67,26 g
m(H) = 8,47 g
m(N) = 4,36 g
m(O) = 19,91 g
Vi beräknar substansmängderna som motsvarar de här massorna:
n(C) = m(C) / M(C) = 67,26 g / 12,01 g/mol = 5,600 mol
n(H) = m(H) / M(H) = 8,47 g / 1,008 g/mol = 8,402 mol
n(N) = m(N) / M(N) = 4,36 g / 14,01 g/mol = 0,3112 mol
n(O) = m(O) / M(O) = 19,91 g / 16,00 g/mol = 1,244 mol
Vi dividerar med den minsta substansmängden, allts substansmängden för kväve:
n(C) / n(N) = 5,600… mol / 0,3112… mol = 17,996 ≈ 18
n(H) / n(N) = 8,402… mol / 0,3112… mol = 27,001 ≈ 27
n(N) / n(N) = 0,3112… mol / 0,3112… mol = 1,000 ≈ 1
n(O) / n(N) = 1,244… mol / 0,3112… mol = 3,998 ≈ 4
(2 p.)
- Substansmängderna har beräknats utgående från vilken massa som helst, 1 p. Proportionsformelns talvärden har beräknats genom att dividera med den minsta substansmängden, 1 p.
Proportionsformeln är C₁₈H₂₇NO₄
(2 p.)
- Formeln är skriven med rätt talvärden, 1 p. Det framgår i ord eller med en matematisk beteckning att det är fråga om en proportionsformel, 1 p.
Det procentuella utbytet har beaktats:
m(X) = 2,000 g
m(Z, utbytes-% 89 %) = 1,357 g
Vi räknar hur mycket det som mest hade kunnat bildas av föreningen Z i reaktionen om utbytet hade varit 100 %:
m(Z, utbytes-% 100 %) = m(Z, utbytes-% 89 %) / 0,89 = 1,357 g / 0,89 = 1,5247191 g.
(2 p.)
Stökiometrin har beaktats:
n(X) = n(Z)
(1 p.)
Molekylformeln har motiverats med beräkningar, till exempel:
Molmassorna för X och Z har följande samband:
M(X) = M(Z) + M(CO2) + M(C4H8) = M(Z) + 100,114 g/mol.
m(X) / M(X) = m(Z, utbytes-% 100 %) / M(Z).
m(X) / (M(Z) + 100,114 g/mol) = m(Z, utbytes-% 100 %) / M(Z)
M(Z) = m(Z, utbytes-% 100 %) · 100,114 g/mol / (m(X) − m(Z, utbytes-% 100 %))
= 1,5247191 g · 100,114 g/mol / (2,000 g − 1,5247191 g)
= 321,169 g/mol.
Vi bestämmer sedan hur många gånger proportionsformeln C₁₈H₂₇NO₄ förekommer i molekylformeln för Z genom att jämföra molmassorna för proportionsformeln och för Z:
M(Z) = x · (C₁₈H₂₇NO₄) = 321,169 g/mol
x = M(C₁₈H₂₇NO₄) / M(Z) = 1
(4 p.)
- Alla olika slag korrekta motiveringar som formulerats med hjälp av beräkningar godkänns.
- Motiveringar enbart i ord utan beräkningar godkänns inte.
Rätt svar:
Molekylformeln är C₁₈H₂₇NO₄.
(1 p.)
9.2 Aminen Z är svårlöslig i vatten. Däremot löser sig aminens salt Y bättre i vatten. Därför undersökte man syra-basegenskaperna för aminen Z genom att lösa upp 0,028 millimol av aminens salt Y i vatten så att lösningens totalvolym blev 0,100 l. Lösningen som bildades hade pH-värdet 6,36. Beräkna baskonstantens värde (t = 25 °C) för aminen Z. 8 p.
c(Y) = n / V = 0,028 · 10⁻³ mol / 0,100 l) = 2,8 · 10⁻⁴ mol/l
(1 p.)
[H3O+] = 10–pH mol/l = 10–6,36 mol/l
(1 p.)
| BH⁺ | + | H₂O | ⇌ | B | + | H₃O⁺ | |
| I början (mol/l) | 2,8 · 10⁻⁴ | 0 | 0 | ||||
| Vid jämv. (mol/l) | 2,8 · 10⁻⁴ − 10−6,36 | 10−6,36 | 10−6,36 |
(BH⁺ = förening Y, B = förening Z)
(2 p.)
- Tabellen måste inte ställas upp i svaret. Situationen kan framgå ur korrekt insättning i uttrycket för syrakonstanten.
Vi beräknar värdet för syrakonstanten för Y:
Ka= [B][H₃O⁺] / [BH⁺] = (10−6,36)² / ((2,8 · 10⁻⁴ – 10−6,36)) = 6,8158 · 10⁻¹⁰.
(2 p.)
- Det räcker inte att enbart skriva uttrycket för syrakonstanten, även insättning av rätt värden krävs.
Med hjälp av syrakonstanten för förening Y kan vi bestämma baskonstanten för förening Z:
Kb = Kw/Ka
(1 p.)
= 1,008 · 10⁻¹⁴ / 6,8158 · 10⁻¹⁰ = 1,4789 · 10⁻⁵ ≈ 1,5 · 10⁻⁵ (1,48 · 10⁻⁵).
(1 p.)
- Om värdet pKw = 14 eller Kw = 1,0 · 10⁻¹⁴ använts blir svaret 1,47 · 10⁻⁵
- Jämviktskonstanterna och uttrycken som hör ihop med jämviktskonstanterna godkänns med eller utan enheter.
10. Reaktioner i en tvättmaskin 20 p.
10.1 En vattenlösning av väteperoxid sönderfaller till vatten och syrgas. I reaktionen kan man använda kaliumjodid som katalysator. I det första skedet oxideras jodidjonerna med hjälp av väteperoxiden till hypojoditjoner \mathrm{IO}^-. I det andra skedet reagerar hypojoditjonerna med väteperoxid och bildar jodidjoner, vatten och syrgas. Skriv reaktionsformlerna som beskriver den här katalyserade reaktionen och ange oxidationstillstånden (oxidationstalen) för jod i de olika skedena av reaktionen. 5 p.
H₂O₂(aq) + I⁻(aq) → H₂O (l) + IO⁻(aq)
IO⁻(aq) + H₂O₂(aq) → H₂O(l) + O₂(g) + I⁻(aq)
(3 p.)
- Rätt ämnen, laddningar och koefficienter i den första reaktionsformeln, 1 p. Rätt ämnen, laddningar och koefficienter i den andra reaktionsformeln, 1 p. Alla aggregationstillstånd rätt i båda reaktionsformlerna, 1 p. Aggregationstillståndspoängen är bunden till rätt ämnen och koefficienter.
Oxidationstillstånden:
IO⁻: +1 eller +I
I⁻: –1 eller –I
(2 p.)
10.2 I material beskrivs funktionsprincipen för katalysatorer i tvättmedel. Motivera varför man kan använda lägre temperaturer vid blekande tvätt med hjälp av katalysatorer som tillsatts i tvättmedlen än vid blekande tvätt utan katalysatorer. Hurdana egenskaper förutsätts av katalysatorer som ska kunna användas i tvättmedel som säljs till konsumenter? 5 p.
Katalysatorn sänker aktiveringsenergin för blekningsreaktionen.
(2 p.)
- Enbart omnämnandet att katalysatorn gör reaktionen snabbare utan att aktiveringsenergin omnämns, 1 p.
Högst 3 p. för följande egenskaper:
- förmånligt pris (1 p.)
- bra hållbarhet (1 p.)
- effektivitet / bra på att försnabba reaktionen / en liten mängd räcker till / sönderfaller inte för snabbt vid användningen eller vid olika temperaturer / fungerar vid brukstemperaturen (1 p.)
- vattenlöslighet (1 p.)
- användningen skadar inte miljön (1 p.)
- inte skadlig för användaren, textilierna eller tvättmaskinen (1 p.)
- produktionen av katalysatorn är miljövänlig (1 p.)
- någon aspekt som berör råvarorna som behövs för katalysatorn: de är tillgängliga, det finns tillräckligt av dem, de är förnybara/kan återanvändas. (1 p.)
10.3 Väteperoxid, natriumkarbonat och TAED reagerar i vatten. Då bildas DAED, perättiksyrans natriumsalt och natriumvätekarbonat. Skriv reaktionsformeln (reaktionslikheten) för den här reaktionen och rita också strukturformeln för perättiksyrans natriumsalt. Utnyttja material och . Du kan använda förkortningarna TAED och DAED i ditt svar. 6 p.
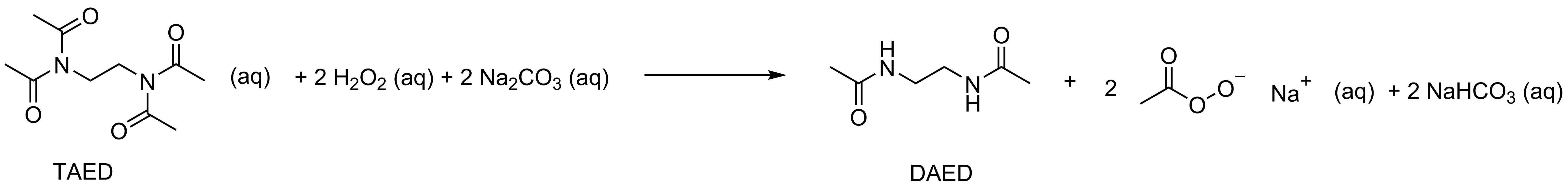 Den efterfrågade reaktionsformeln
Den efterfrågade reaktionsformeln
Reaktionsformeln
(3 p.)
- Rätt ämnen, 1 p., rätt koefficienter, 1 p., och rätt aggregationstillstånd, 1 p. Koefficienternas och aggregationstillståndens poäng är bundna till rätt ämnen. Om ämnen saknas eller är överlopps, 0 p. Felaktiga laddningar tolkas som att ämnet är fel.
Strukturformeln för perättiksyran
(3 p.)
10.4
Ketoner reagerar med väteperoxid i en sur lösning och bildar peroxider som har ringstruktur. En del av de här peroxiderna är farligt explosiva. Det är dock tryggt att använda den peroxid som bildas utifrån butan-2-on, alltså MEK-peroxid, som polymerisationskatalysator för omättade föreningar till exempel då man tillverkar glasfiberbåtar.
Molekylformeln för MEK-peroxid är C₈H₁₆O₄ och den har en ring med sex atomer i sin struktur. Rita strukturformeln för MEK-peroxid då vi vet att den bildas i reaktionen mellan butan-2-on och väteperoxid. O–O-bindningarna brister inte under bildningsreaktionen.
4 p.
11. Fosfor och Östersjön 20 p.
11.1
Man har följt med halten av fosfor i Östersjöns ytvatten under en lång tid. År 1958 var ytvattnets fosforhalt 8,36 mikrogram per liter. Ytvattnets fosforkoncentration (millimol per kubikmeter) under tiden 1970–2018 visas i graf .
Hur många gånger större blev ytvattnets fosforhalt från år 1958 till år 2018? Motivera ditt svar med en beräkning.
6 p.
År 1958 var fosforhalten 8,36 · 10⁻⁶ g/l = 8,36 · 10⁻³ g/m³.
(1 p.)
Mängden fosfor i en kubikmeter:
m(P) = 0,00836 g
n(P) = m(P)/M(P) = 0,00836 g / (30,97 g/mol) = 0,00026994 mol.
(1 p.)
År 2018 var halten (avläst ur grafen) ca 1,05 mmol/m³.
(2 p.)
- Värden inom intervallet 1,05 mmol/m³ – 1,15 mmol/m³ godkänns.
Haltens (mmol/m³) ökning 1,05 / 0,26994 = 3,8898,
(1 p.)
så halten blev ca 3,9 gånger så stor (som i början).
(1 p.)
- I svaret godkänns 3,89 – 4,26 gånger så stor. Även ett svar med ord, som ”ca fyra gånger så stor” godkänns.
11.2
Studera graf som visar mängden fosforutsläpp från landområden (alltså fosforbelastningen), den syrefria bottenytan samt ytvattnets fosforkoncentration.
Beskriv förändringarna i fosforbelastningen från landområdena och förändringarna i den syrefria bottenytan under olika årtionden. Bedöm dessas samband med förändringarna i ytvattnets fosforkoncentration.
7 p.
Observationer om den syrefria bottenytan, högst 2 p., 1 p. per observation:
- 1970–2002 har den syrefria bottenytan varierat mycket (0–35000 km²) men alltid återgått till nära noll.
- 2002–2007 har den syrefria bottenytan vuxit tydligt (0 → 45 000)
- 2007–2018 har de syrefria bottenytan stabiliserats på en (bestående) högre nivå än tidigare (medelvärdet har ökat 15 000 → 45 000).
- 1970–2002 är trenden vågrät eller aningen sjunkande
- 2002–2018 är trenden stigande
- 1970–2002 är variationerna i maximi- och minimivärden i medeltal större (18 000 ± 18 000) än 2007–2018 (medelvärdet 45 000 ± 10 000)
- 1970–2002 varierar ytans minimum/maximum i ca 5–10 års cykler
- 2002–2018 varierar ytans minimum/maximum i cykler som är kortare än 5 år
Observationer om belastningen från landområden, högst 2 p., 1 p. per observation:
- Maximi- och minimivärdena hålls inom samma intervall under hela den granskade tidsperioden (ca 10 ∙ 10⁶ kg/år, min → max → min)
- 1970–1985 ökar belastningen jämnt (en så här jämn tillväxt är onaturlig så det kan vara fråga om någon slags extrapolering)
- 1985–1995 fortsätter belastningen öka
- 1970–1995 har mängden fosfor från landområdena ökat
- 1995–2015 har mängden fosfor från landområdena minskat
- Maximi- och minimivärdena följer varandra i ungefär samma takt under hela den granskade tidsperioden (cykler på ca 2–3 år).
Sambandet mellan ytvattnets fosforkoncentration och den syrefria bottenytan samt belastningen från landområden, högst 3 p., 1 p. per observation:
- Allmänt kan vi se att ytvattnets fosforkoncentration och den syrefria bottenytans storlek korrelerar med varandra / växer och minskar i samma takt / förändringarna följer varandra.
- Allmänt kan vi se att ytvattnets fosforkoncentration och fosforbelastningen från markområdena inte korrelerar med varandra / inte växer och minskar i samma takt / förändringarna inte följer varandra.
- 1970–1995 har fosforkoncentrationen i ytvattnet vuxit samtidigt som fosforbelastningen från landområdena har vuxit. Likheterna i trenderna tar dock slut här.
- 1995–2015 har ytvattnets fosforkoncentration fortsatt att växa även om belastningen från landområdena har minskat.
- Den syrefria ytans maximi- och minimiställen korrelerar rätt så bra även på kortare tidsperioder med maximi- och minimiställena i ytvattnets fosforkoncentration.
- Förändringarna i ytvattnets fosforkoncentration ser (i någon mån) ut att förutsäga förändringar i den syrefria bottenytan, men inte tvärtom.
11.3
En del av fosforn binds till Östersjöns botten som mineralet vivianit, Fe₃(PO₄)₂·8H₂O. Man undersöker motsvarande process som en möjlig metod för att fälla ut fosfat med hjälp av Fe³⁺-joner i vattenreningsverk.
Varför måste Fe³⁺-jonerna först reduceras för att vivianit ska kunna bildas?
Vilka är följderna av att fosfor inte samlas in? Bedöm också följderna på lång sikt.
7 p.
Järnets reduktion har motiverats:
I vivianit är järnjonernas laddning 2+ / är järnets oxidationstillstånd +2, och därför måste Fe³⁺-jonerna först reduceras till Fe²⁺-joner.
(2 p.)
Betydelsen av att ta fosfor tillvara har beskrivits med två olika aspekter som har motiverats. Poängsättning: 1 p. / aspekt som har motiverats, av följande alternativ:
Fosforutsläppen i vattendragen ökar
- ökning i skadorna i vattenreningsinfrastrukturen
- tilltagande eutrofiering/övergödning
- en ökning i utsläppen av växthusgaser / metan
- syrebristen tilltar
- mängden blågröna alger (cyanobakterier) ökar
- fosfor lagras i bottensedimenten
- vattenkvaliteten försvagas
- det uppstår bestående förändringar i ekosystemet
- klimatförändringen förstärks
Gruvdriften ökar
- ökande kostnader
- ökande behov av energi
- mera utsläpp
- en minskning av rekreationsområden
- en ökad konkurrens
- energipriserna stiger
- naturens mångfald minskar
- erosionen ökar
- klimatförändringen förstärks
Behovet av fosfor ökar
- gruvdriften ökar
- fosfor är en icke-förnybar naturresurs
- fosforn sinar
Matförsörjningen försvagas
- fler störningar i lantbruket
- livsmedelspriserna stiger
- de geopolitiska spänningarna blir starkare
- risken för konflikter ökar
Mängden avfall ökar
- avfallshanteringen blir svårare eller sköts inte alls om för att det bildas mer avfall än man kan ta hand om
- en ökning i ekologiska skador
- ekosystemet blir utarmat