Hyvän vastauksen piirteet: FI – Kemia
22.3.2024
Lopulliset hyvän vastauksen piirteet 14.5.2024
Lopullisista hyvän vastauksen piirteistä ilmenevät perusteet, joiden mukaan koesuorituksen lopullinen arvostelu on suoritettu. Tieto siitä, miten arvosteluperusteita on sovellettu kokelaan koesuoritukseen, muodostuu kokelaan koesuorituksestaan saamista pisteistä, lopullisista hyvän vastauksen piirteistä ja lautakunnan määräyksissä ja ohjeissa annetuista arvostelua koskevista määräyksistä. Lopulliset hyvän vastauksen piirteet eivät välttämättä sisällä ja kuvaa tehtävien kaikkia hyväksyttyjä vastausvaihtoehtoja tai hyväksytyn vastauksen kaikkia hyväksyttyjä yksityiskohtia. Koesuorituksessa mahdollisesti olevat arvostelumerkinnät katsotaan muistiinpanoluonteisiksi, eivätkä ne tai niiden puuttuminen näin ollen suoraan kerro arvosteluperusteiden soveltamisesta koesuoritukseen.
Ylioppilastutkinnon kokeessa selvitetään, ovatko opiskelijat omaksuneet lukion opetussuunnitelman mukaiset tiedot ja taidot sekä saavuttaneet lukiokoulutuksen tavoitteiden mukaisen riittävän kypsyyden. Kemian kokeessa arvioinnin kohteina ovat kemiallisen tiedon ymmärtäminen ja soveltaminen. Arvioinnissa otetaan huomioon myös kokeellisen tiedonhankinnan ja ‐käsittelyn taidot. Näihin kuuluvat esimerkiksi kokeiden suunnittelu, työvälineiden ja reagenssien turvallinen käyttö, tulosten esittäminen ja tulkitseminen sekä johtopäätösten tekeminen ja soveltaminen.
Kemian tehtäviä arvosteltaessa painotetaan oppiaineen luonteen mukaista esitystapaa sekä käsitteiden ja kielenkäytön täsmällisyyttä. Reaktioyhtälöt esitetään ilman hapetuslukuja pienimmin mahdollisin kokonaislukukertoimin ja olomuodoilla varustettuna. Orgaanisissa reaktioyhtälöissä käytetään rakennekaavoja, mutta olomuotoja ei tarvitse mainita. Rakennekaavojen eri esitystavat hyväksytään.
Laskennallisissa tehtävissä suureyhtälöjä ja kaavoja käytetään tavalla, joka osoittaa kokelaan ymmärtäneen tehtävänannon oikein ja soveltaneen ratkaisussaan asianmukaista periaatetta tai lakia. Vastauksesta ilmenee yksiselitteisesti, miten lopputulokseen päädytään, mutta laajoja välivaiheita ei tarvita. CAS-ohjelmia voi hyödyntää tehtävän eri vaiheissa. Merkintätapojen kannalta keskeisiä vaiheita ovat periaatteiden ja lakien sekä lopputuloksen ja johtopäätösten esittäminen. Lopputulokset annetaan lähtöarvojen mukaisella tarkkuudella yksiköineen ja johtopäätökset perustellaan.
Mittaustuloksia ja niistä piirrettyjä kuvaajia hyödynnetään tiedon analysoinnissa ja johtopäätösten tekemisessä. Mittauspisteisiin sovitetaan asianmukainen suora. Mittauspisteiden välisiä arvoja voi interpoloida kuvaajaa silmämääräisesti lukemalla tai sopivalla ohjelmalla. Kuvaajaan merkitään akselien nimet, yksiköt ja asteikko. Kuvaajaan merkitään johtopäätösten kannalta olennaiset kohdat, kuten titrauskäyrän ekvivalenttikohta tai hetkellistä nopeutta laskettaessa kyseinen tangentti.
Essee‐ ja selittävissä vastauksissa tekstiä täydennetään reaktioyhtälöillä, kaavoilla tai piirroksilla. Käsiteltäviä ilmiöitä kuvataan makroskooppisella, mikroskooppisella ja symbolisella tasolla. Vastauksesta ilmenee, että tehtävään liittyvää aineistoa on hyödynnetty, sovellettu, analysoitu ja arvioitu tehtävänannon mukaisesti. Hyvä vastaus on jäsennelty ja sisällöltään johdonmukainen.
Vastaus arvostellaan tehtäväkohtaisten kriteerien mukaisesti. Lähtökohtana ovat vastauksen ansiot, joista kertyy pisteitä. Jos keskeinen kemiallinen periaate puuttuu tai se on virheellinen, pisteiden kertyminen päättyy. Tällöin virheellisen tuloksen siirtymistä eteenpäin ei hyväksytä (ei-VSE). Tällaiset virheet ovat esimerkiksi stoikiometriavirheet, väärä rajoittava tekijä tai väärä aine reaktioyhtälössä. Muiden puutteiden tai virheiden tapauksessa virheellisen tuloksen siirtyminen eteenpäin hyväksytään (VSE), jolloin pisteiden kertyminen jatkuu puutteen tai virheen jälkeen. Kokeen osan 3 vaativat tehtävät edellyttävät täsmällisempää periaatteiden hallintaa kuin kokeen alkupään perustehtävät. Kemian kannalta epätäsmällisestä kielenkäytöstä, pienestä laskuvirheestä tai likiarvojen huolimattomasta käytöstä vähennetään 0–3 p. esimerkiksi seuraavasti:
- pyöristys- ja kopiointivirheet, jotka eivät vaikuta lopputulokseen, −0 p.
- kopiontivirheet, pyöristysvirheet ja pienet huolimattomuusvirheet, jotka vaikuttavat lopputulokseen, yksittäinen pieni virhe rakennekaavassa −1 p.
- yksikönmuunnosvirheet, systemaattinen virhe rakennekaavassa tai muut vähäistä suuremmat virheet, jossa ei kuitenkaan ole väärä kemiallinen periaate, −2 p.
4.6.2024 klo 11.30 korjattu kokonaisreaktion pisteitystä osatehtävässä 9.3.
Osa 1: 20 pisteen tehtävä
1. Monivalintatehtäviä kemian eri osa-alueilta 20 p.
1.1 Mikä seuraavista aineista on huoneenlämpötilassa olomuodoltaan kaasu? 2 p.
- hiilimonoksidi (2 p.)
1.2 Millä seuraavista aineista on suurin elektronegatiivisuus? 2 p.
- F (2 p.)
1.3 Minkä suolan vesiliuos on hapan? 2 p.
- NH₄Cl (2 p.)
1.4 Mitä tapahtuu reaktiossa 2CuSO₄ + 4KI → 2CuI + I₂ + 2K₂SO₄? 2 p.
- Jodi hapettuu ja kupari pelkistyy. (2 p.)
1.5 Mitä yhdistettä muodostuu veden lisäksi, kun butanoli ja etaanihappo reagoivat? 2 p.
- butyylietanaattia (2 p.)
1.6 Yhden moolin ideaalikaasunäytteen tilavuus kaksinkertaistuu, kun lämpötila pysyy muuttumattomana. Tällöin sen paine 2 p.
- puolittuu. (2 p.)
1.7 Millä seuraavista metallipareista saadaan suurin kennojännite? 2 p.
- Ni ja Mg (2 p.)
1.8 Mikä seuraavista yhdistelmistä voisi toimia puskuriliuoksena? 2 p.
- NH₃(aq) ja NH₄Cl(aq) (2 p.)
1.9 Tislaamalla voidaan erottaa toisiinsa liuenneita aineita. Tislaus perustuu eroihin aineiden 2 p.
- kiehumispisteessä. (2 p.)
1.10 Typpikaasussa molekyylien välillä on 2 p.
- dispersiovoimia. (2 p.)
Osa 2: 15 pisteen tehtävät
2. Vedyn valmistus ja käyttö polttoaineena 15 p.
2.1 Eräässä elektrolyysikokeessa vetyä valmistettiin vedestä. Kokeen aikana reagoi 300,0 g vettä. Syntyneet kaasut kerättiin talteen. Kuinka suuri oli näin syntyneen vetykaasun ja kuinka suuri happikaasun tilavuus? Molempien kaasujen paine oli 101,325 kPa ja lämpötila 293,15 K. 8 p.
n(H₂O) = m / M = 300,0 g / 18,016 g/mol = 16,6519 mol
(1 p.)
Reaktioyhtälön 2 H₂O(l) → 2 H₂(g) + O₂(g)
(1 p.)
mukaan
n(H₂) = n(H₂O) = 16,6519 mol
(1 p.)
n(O₂) = ½ · n(H₂O) = ½ · 16,6519 mol = 8,325 95 mol
(1 p.)
- jos stoikiometria on virheellinen tai ainemäärän laskussa on muuta periaatevirhettä, kaasun tilavuuslaskusta ei voi ansaita pisteitä (ei-VSE)
V(H₂) = n(H₂) · RT/p = 16,1659 mol · 8,314 46 Pa · m³ / (mol · K) · 293,15 K / (101 325 Pa)
V(H₂) = 0,4005624 m³ ≈ 0,4006 m³ = 400,6 l
(2 p.)
V(O₂) = n(O₂) · RT/p = 8,32595 mol · 8,314 46 Pa · m³ / (mol · K) · 293,15 K / (101 325 Pa)
V(O₂) = 0,2002812 m³ ≈ 0,2003 m³ = 200,3 l
(2 p.)
- Yksikönmuunnoksen virheet, −2 p. vähennys osatehtävästä
- Pienet laskuvirheet, kuten näppäilyvirheet ja pyöristysvirheet, −1 p./virhe
- Numerotarkkuus vastauksessa ei vastaa tehtävänantoa, −1 p. vähennys osatehtävästä
- Tehtävässä voi käyttää moolitilavuuden arvoa Vₘ = 24,055 dm³/mol, koska se vastaa tehtävänannon olosuhteita (p, T). Virheellisellä moolitilavuudella laskettuna, 0 p. tilavuuksien laskuista.
2.2 Kun laboratoriossa valmistetaan vetyä veden elektrolyysillä, käytetään usein puhtaan veden sijaan vettä, johon on liuotettu natriumsulfaattia tai jotain muuta suolaa. Selitä, miksi näin tehdään. 3 p.
Puhdas vesi johtaa huonosti sähköä,
TAI Suolan lisääminen parantaa sähkönjohtavuutta / tehostaa elektrolyysiä / nopeuttaa reaktiota (1 p.)
- Ei hyväksytä, jos suolan on sanottu olevan katalyytti.
koska siinä on hyvin vähän varauksen kuljettajia. Vesiliuoksessa natriumsulfaatti (tai jokin muu suola) on hajonnut negatiivisen ja positiivisen varauksen omaaviksi ioneiksi. (1 p.)
- Vaaditaan, että hajoaminen ioneiksi on tunnistettu.
Nämä ionit toimivat liuoksessa varauksen kuljettajina (1 p.) (ja lisäävät sähkönjohtavuutta. Suurempi sähkönjohtavuus helpottaa elektrolyysireaktion vaatiman sähkövirran johtamista vesiliuoksen läpi).
2.3 Kun vetyä käytetään liikennepolttoaineena, autossa oleva polttokenno tuottaa vedystä sähköä, jolla auton sähkömoottori toimii. Kuvaa yhtä etua ja yhtä haittaa, jotka liittyvät vedyn käyttöön liikennepolttoaineena. 4 p.
Edun mainitseminen 1 p., tarkempi selitys 1 p. (Vain yksi etu ja tämän edun selitys huomioidaan pisteityksessä)
- Etu: Käytössä syntyy vettä. / Käytössä ympäristöystävällinen.
Tarkennus: Käytössä syntyy vain vettä TAI Ei synny kasvihuonekaasuja / ilmansaasteita / haitallisia aineita. - Etu: Vedyn valmistuksessa ei synny kasvihuonekaasuja,
Tarkennus: jos veden elektrolyysin sähkö on tuotettu uusiutuvalla energialla. - Etu: Vedyn energiasisältö on suuri
Tarkennus: massayksikköä kohden. - Etu: Vedyn tankkaus on nopeaa
Tarkennus: verrattuna sähköauton lataamiseen. - Etu: Polttokennon teho on hyvä
Tarkennus: myös kylmällä. - Etu: Vedyn käytöllä voidaan korvata fossiilisia polttoaineita,
Tarkennus: jotka ovat uusiutumattomia luonnonvaroja / jotka tuottavat kasvihuonekaasuja.
Haitan mainitseminen 1 p., tarkempi selitys 1 p. (Vain yksi haitta ja tämän haitan selitys huomioidaan pisteityksessä)
- Haitta: Vetyä on hankala varastoida / kuljettaa,
Tarkennus: koska vety on hyvin reaktiivinen / vuotaa herkästi materiaalien läpi TAI tämä vaatii korkeaa painetta / matalaa lämpötilaa TAI koska vety omaa alhaisen kiehumispisteen. - Haitta: Vety on räjähdysherkkä / paloturvallisuusriski,
Tarkennus: jos vety reagoi hapen / ilman kanssa. - Haitta: Vedyn energiasisältö on pieni
Tarkennus: tilavuusyksikköä kohden. - Haitta: Vedyn valmistus tuottaa hiilidioksidipäästöjä,
Tarkennus: jos vety valmistetaan fossiilisista polttoaineista / jos valmistuksessa käytettävä sähkö tuotetaan fossiilisilla polttoaineilla. - Haitta: Sähkön/energian kulutus lisääntyy,
Tarkennus: koska vedyn valmistus vaatii runsaasti energiaa/sähköä. - Haitta: Vedyn tankkausmahdollisuuksia ei ole,
Tarkennus: koska jakeluverkkoa ei ole vielä.
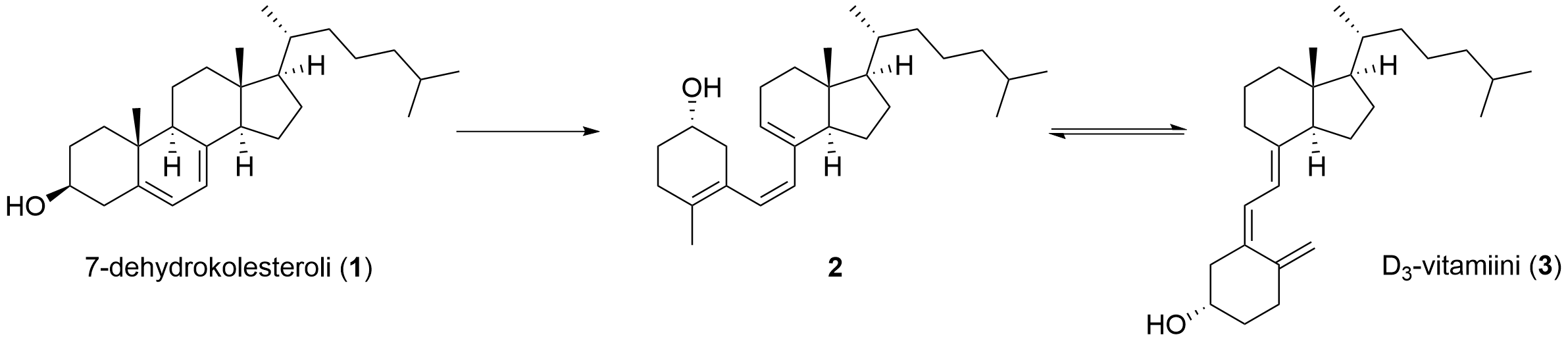
3. D₃-vitamiini 15 p.
D₃-vitamiinin (3) muodostuminen 7-dehydrokolesterolista (1) voidaan kuvata alla olevalla reaktioyhtälöllä.
Kun iho altistuu auringonvalolle, 7-dehydrokolesterolista (1) muodostuu iholla D₃-vitamiinia (3). Korkeaenergisen UV-B-säteilyn vaikutuksesta 7-dehydrokolesterolista (1) muodostuu ensin yhdiste 2. Sen jälkeen yhdiste 2 isomeroituu D₃-vitamiiniksi (3). Yhdisteen 2 ja D₃-vitamiinin (3) välinen reaktio on tasapainoreaktio, jonka tasapainovakion suuruus riippuu ihon lämpötilasta.
Voit hyödyntää osatehtävissä aineistoja ja .
3.1 Ovatko 7-dehydrokolesteroli (1) ja yhdiste 2 keskenään isomeerejä? Perustele vastauksesi. 3 p.
Yhdisteet ovat keskenään isomeerejä (1 p.), koska niillä on sama molekyylikaava (1 p.).
7-dehydrokolesterolin (1) molekyylikaava on C₂₇H₄₄O ja yhdisteen 2 kaava myös C₂₇H₄₄O
(1 p.) (, eli ne ovat isomeerejä).
3.2 Kuuluuko D₃-vitamiini (3) vesi- vai rasvaliukoisiin vitamiineihin? Perustele vastauksesi. 4 p.
D3-vitamiini koostuu poolittomasta hiilivetyrungosta (1 p.), ja siinä on ainoastaan yksi poolinen ryhmä, hydroksiryhmä (1 p.) (, joka voi muodostaa vetysidoksia veden kanssa).
Molekyylin poolittomat osat ovat suhteellisen suuria, minkä vuoksi yksittäisen hydroksiryhmän vaikutus liukoisuuteen jää vähäiseksi.
(1 p.)
D3-vitamiini (liukenee siis paremmin poolittomiin yhdisteisiin kuin veteen ja) kuuluu siten rasvaliukoisiin vitamiineihin.
(1 p.)
- Jos virheellinen tieto kumoaa oikean tiedon, kyseinen piste menetetään.
3.3 Erään tutkimuksen mukaan yhdisteen 2 ja D₃-vitamiinin (3) välisen isomeroitumisreaktion tasapainovakion (K) arvo ihmisen ihon lämpötilassa on 11,4. Kun reaktio on saavuttanut tasapainon, on muodostunut seos, jossa on sekä D₃-vitamiinia (3) että yhdistettä 2. Kuinka monta prosenttia tästä seoksesta on D₃-vitamiinia (3)? 8 p.
Muodostetaan tasapainovakion lauseke: K = [D₃] / [2] = 11,4.
(1 p.)
- Jos tasapainovakion lauseke on väärin, pisteiden kertyminen päättyy (ei–VSE), 0 p. osatehtävästä.
Yhdisteen 2 ja D₃-vitamiinin kokonaiskonsentraatio iholla:
c(kok.) = c(2) + c(D₃)
(1 p.)
- Jos tehtävä on ratkaistu vain ainemäärillä, täytyy perustella, että tilavuudet supistuvat pois tasapainovakion lausekkeesta, muuten −2 p. vähennys.
Alkutilanteessa D₃-vitamiinia ei ole vielä muodostunut, jolloin pätee c(2, alussa) = c(kok).
Muodostetaan tasapainotaulukko:
| Yhdiste 2 | D₃ | |
|---|---|---|
| Alussa | c(kok.) | 0 |
| Tasapainossa | c(kok.) – x | x |
(2 p.)
Sijoitetaan tasapainokonsentraatiot tasapainovakion lausekkeeseen:
K = [D₃] / [2]
x / (c(kok.) – x) = 11,4
(1 p.)
x = 11,4 ∙ c(kok.) – 11,4 ∙ x
12,4 ∙ x = 11,4 ∙ c(kok.)
x = 11,4 ∙ c(kok.) / 12,4
D₃-vitamiinin osuus kokonaismäärästä:
c(D₃) / c(kok.) = x / c(kok.)
(1 p.)
= 11,4 ∙ c(kok.) / (12,4 ∙ c(kok.)) = 11,4 / 12,4 = 0,91935 ≈ 91,9 %
(2 p.)
- Vastauksesta on käytävä ilmi, että tasapainotilanne on hahmoteltu oikein.
4. Titraus 15 p.
4.1 Mitä välineitä tarvitset titraukseen? Selitä vaihe vaiheelta, miten titraus tehdään käytännössä. Miten ekvivalenttipiste havaitaan? 11 p.
Titraukseen tarvitaan seuraavat välineet:
(1 p./väline, korkeintaan 3 p.)
- Byretti
- Täyspipetti/mittapipetti/mittalasi(, jolla etikkahappoliuosta mitataan tarkasti.)
- pH-mittari / pH-elektrodi / indikaattoriliuos
Lisäksi korkeintaan 1 p. seuraavista välineistä (yksi väline riittää)
- Dekantterilasi tai vastaava astia (, jossa on reagenssi, jonka konsentraatio määritetään.)
- Statiivi (ja kourat)
- Magneettisekoittaja / lasisauva / muu sekoittamiseen soveltuva väline
Vastauksessa on kuvattu titrauksen suorittaminen.
(1 p./kohta, korkeintaan 6 p.)
- Etikkahappoa mitataan tarkka tilavuus / tarkalla mittausvälineellä dekantterilasiin.
- Natriumhydroksidiliuosta lisätään byrettiin.
- Natriumhydroksidi, (jonka konsentraatio tunnetaan), lisätään vähän kerrallaan/tipoittain byretistä.
- Natriumhydroksidi lisätään etikkahappoon (, joka on dekantterilasissa).
- Kulutus kirjataan työn aikana (tehdään laboratoriopäiväkirja/pöytäkirja).
- Luetaan byretin asteikko: byretissä kaarevan pinnan alimman kohdan tulee olla byretin viivan kohdalla.
- Liuos sekoitetaan / magneettisekoittaja pidetään jatkuvasti päällä.
Ekvivalenttipisteen havaitseminen on vastauksessa selitetty. (2 p.)
- Selitys indikaattorin avulla: titraus lopetetaan, kun havaitaan värimuutos (1 p.), joka on pysyvä (1 p.).
TAI
- Selitys pH-mittarin avulla: pH-arvoa mitataan (1 p.), kunnes ekvivalenttipiste on ohitettu, ja ekvivalenttipiste määritetään titrauskäyrän jyrkimmän nousun keskikohdalta / derivaatan avulla (1 p.).
- Jos vastauksessa ei kuvata titrausta, 0 p. osatehtävästä.
- Jos titraus ei perustu neutralointiin voi ansaita korkeintaan 2 p. osatehtävästä. Nämä pisteet tulevat suorituksen kuvauksista, jos NaOH ja etikkahappo ovat alussa oikeissa astioissa/välineissä.
4.2 Onko liuos titrauksen ekvivalenttipisteessä hapan, neutraali vai emäksinen? Kumpi on parempi indikaattori tässä titrauksessa: metyylipunainen vai fenoliftaleiini? Perustele vastauksesi ilman laskuja. 4 p.
Ekvivalenttipisteessä liuos on emäksinen (1 p.), koska titrataan heikkoa happoa vahvalla emäksellä / koska ekvivalenttipisteessä liuoksessa on asetaatti-ionia, joka on heikko emäs (1 p.).
Indikaattoriksi soveltuu fenoliftaleiini (1 p.), koska sen värinmuutos tapahtuu pH-arvossa 8,3–10,0 / emäksisessä pH-arvossa (1 p.).
- Kaksi jälkimmäistä pistettä voi ansaita vain, jos vastauksessa on kuvattu, että liuos on emäksinen.
5. Videoita reaktioista ja reaktioyhtälöiden kirjoittaminen 15 p.
5.1 Katso video . Magnesiumnauhan pala lisätään vetykloridihappoliuokseen. Mitä havaintoja teet reaktiosta? Kirjoita reaktioyhtälö. 5 p.
Havainnot:
Reaktiossa muodostuu kaasukuplia. (1 p.)
Magnesiumnauha syöpyy tai liukenee. (1 p.)
- Havainnon pistettä ei ansaita, jos tapahtuma on tulkittu kemiallisesti väärällä tavalla (esimerkiksi liuos kiehuu, muodostuu happea, tai magnesium sulaa).
Reaktioyhtälö:
2HCl (aq) + Mg (s) → H₂ (g) + MgCl₂ (aq)
Lähtöaine ja reaktiotuotteet (1 p.), kertoimet (1 p.), olomuodot (1 p.)
- Kertoimien ja olomuotojen pisteitä voi ansaita vain, jos aineet ovat oikein.
5.2 Katso video . Kaliumjodidia lisätään vetyperoksidin vesiliuokseen. Kaliumjodidi katalysoi reaktiota. Mitä havaintoja teet reaktiosta? Kirjoita reaktioyhtälö. Katalyyttiä ei tarvitse merkitä reaktioyhtälöön. 5 p.
Havainnot:
Reaktiossa muodostuu kaasukuplia. (1 p.)
Liuoksen väri muuttuu (keltaiseksi). (1 p.)
- Pistettä ei ansaita, jos tapahtuma on tulkittu kemiallisesti väärällä tavalla (esimerkiksi liuos kiehuu, muodostuu vetyä).
Reaktioyhtälö:
2H₂O₂ (aq) → 2H₂O (l/aq) + O₂ (g)
Lähtöaine ja reaktiotuotteet (1 p.), kertoimet (1 p.), olomuodot (1 p.)
- Kertoimien ja olomuotojen pisteitä voi ansaita vain, jos aineet ovat oikein.
5.3 Katso video . Kaliumpermanganaattiliuosta lisätään happamaan rauta(II)sulfaattiliuokseen. Mitä havaintoja teet reaktiosta? Kirjoita reaktioyhtälö. 5 p.
Havainnot:
(Kaliumpermanganaattiliuoksen violetti) väri häviää. (1 p.)
Reaktioyhtälö:
5Fe²⁺ (aq) + MnO₄⁻ (aq) + 8H⁺ (aq) → 5Fe³⁺ (aq) + Mn²⁺ (aq) + 4H₂O (l)
TAI
5Fe²⁺(aq) + MnO₄⁻ (aq) + 8H₃O⁺ (aq) → 5Fe³⁺ (aq) + Mn²⁺ (aq) + 12H₂O (l)
Pisteitys:
- Reaktiosta ilmenee hapettuminen: Fe2+ → Fe3+, 1 p.
- Reaktiosta ilmenee pelkistyminen: Mn7+ → Mn2+, 1 p.
- Kokonaisreaktion aineet ja kertoimet ovat kokonaan oikein, 1 p.
- Kokonaisreaktion olomuodot ovat kokonaan oikein, 1 p. (edellyttäen, että edelliset 3 pistettä on ansaittu).
6. Atomien ja ytimien rakenteet 15 p.
Jokaisesta oikeasta sanasta tai luvusta 1 p.
Oikeana vastauksena hyväksytään numeroarvo myös kirjaimin ilmaistuna. Kemiallisesti oikeat synonyymit hyväksytään.
6.1 1 p.
- 9 (1 p.)
6.2 1 p.
- 7 (1 p.)
6.3 1 p.
- 1 (1 p.)
6.4 1 p.
- neon (1 p.)
6.5 1 p.
- pelkistymiseksi (1 p.)
6.6 1 p.
- kovalenttisilla (1 p.)
6.7 1 p.
- +6 (1 p.)
- +VI (1 p.)
6.8 1 p.
- +6 (1 p.)
- +VI (1 p.)
6.9 1 p.
- 80 (1 p.)
6.10 1 p.
- +4 (1 p.)
- +IV (1 p.)
6.11 1 p.
- 92 (1 p.)
6.12 1 p.
- 143 (1 p.)
6.13 1 p.
- plutonium (1 p.)
- Pu (1 p.)
6.14 1 p.
- 239 (1 p.)
6.15 1 p.
- 94 (1 p.)
Myös muut oikeat ilmaisut hyväksytään.
7. Pakkausmateriaalien kierrätys 15 p.
7.1 Virvoitusjuomia ja elintarvikkeita pakataan usein alumiinista valmistettuihin tölkkeihin, jotka ovat kevyitä ja kestävät hyvin korroosiota. Selitä, mihin perustuu alumiinin hyvä korroosionkesto. 2 p.
Kun alumiini reagoi ilman hapen kanssa, sen pintaan muodostuu nopeasti alumiinioksidi-kerros (1 p.), joka suojaa alumiinia hapettumasta lisää. (1 p.)
Jälkimmäinen piste edellyttää, että jokin suojaava kerros on tunnistettu ja kemiallinen perustelu korroosionkestoon on annettu. Esimerkiksi:
- suojaava kerros on kemiallisesti stabiili
- suojaava kerros on kova/tiivis
- suojaava kerros muodostuu nopeasti
- suojaava kerros toimii sähköisenä eristeenä
7.2 Suuri osa pakkausalumiinista pystytään kierrättämään. Pohdi syitä alumiinin korkealle kierrätysasteelle. 4 p.
Vastauksessa voi pohtia esimerkiksi seuraavia syitä:
- Luonnossa ei esiinny puhdasta alumiinia (1 p.), kun taas kierrätyksestä saadaan lähes puhdasta alumiinia jatkojalostukseen. (1 p.) Tämä kuluttaa vähemmän energiaa ja on siksi myös taloudellisesti kannattavaa. (1 p.)
- Alumiinin kemiallinen rakenne ei muutu / alumiinin laatu ei heikkene kierrätysprosessissa. (1 p.)
- Alumiinia on helppo muotoilla uusiin muotoihin. (1 p.)
- Virvoitusjuomatölkkien panttijärjestelmä kannustaa ihmisiä kierrättämään tölkit. (1 p.) Alumiinin/metallin keräyspisteitä löytyy monesta paikasta. (1 p.) Alumiinin kuljetus on edullista keveyden takia. (1 p.)
7.3 Paperista tai kartongista valmistetut kuitupakkaukset ovat Suomen käytetyin pakkausmateriaali. Paperi ja kartonki koostuvat pääasiallisesti selluloosakuidusta. Kuvaile selluloosan kemiallista rakennetta. Mitkä ovat vahvimmat sidokset selluloosamolekyylien välillä? 4 p.
Selluloosakuidussa vetysidos on vahvin sidos selluloosaketjujen välillä. (1 p.)
- Jos lisäksi on mainittu virheellinen sidos selluloosaketjujen välillä, 0 p.
Selluloosapolymeerin ja -kuidun rakenteen kuvaus, enintään 2 p.:
- Selluloosa koostuu glukoosimonomeereistä. (1 p.)
- Selluloosa on polymeeri/polysakkaridi/hiilihydraatti/makromolekyyli/pitkäketjuinen molekyyli. / Selluloosa sisältää hydroksiryhmiä. (1 p.)
Seuraavista lisäksi enintään 1 p. (yksi huomio riittää):
- Lineaarinen ketju, (minkä syynä on glykosidisidosten konformaatio). (1 p.)
- Voi muodostua useita vetysidoksia. (1 p.)
- Monomeerien välillä on glykosidisidos / happisilta. (1 p.)
7.4 Muovien keveys, kestävyys ja edullisuus tekevät niistä suosittuja pakkausmateriaaleja. Muovien kierrätysaste vaihtelee suuresti muovilaatujen välillä. Pohdi, mitkä seikat vaikeuttavat muovien kierrätystä. Selitä, miksi toiset muovit soveltuvat paremmin ja toiset huonommin kierrätettäväksi. 5 p.
Seikkoja, jotka vaikeuttavat muovien kierrätystä (enintään 3 p.):
Esimerkiksi (1 p./seikka):
- Muovien kemiallinen monimuotoisuus tekee lajittelusta / kierrätyksestä hankalaa.
- Kulutustavaroissa yhdistellään muoveja toisiinsa / muihin materiaaleihin, joiden erottelu on hankalaa / kallista.
- Lisäaineet (pehmentimet / stabilointiaineet / väriaineet) vaikuttavat muovin käsittelyyn ja kierrätettävyyteen.
- Likaiset muovit saastuttavat puhtaita eriä, mikä alentaa lopputuotteen laatua / tekee kierrätyksestä taloudellisesti kannattamatonta.
- Muovien valmistus on edullista / alhainen raaka-ainearvo, joten kierrätys ei ole aina taloudellisesti kannattavaa.
- Muovia on helppo polttaa / käyttää energiantuotantoon ja tämä vähentää kierrätystä.
- Muovipakkausten keräyspisteitä harvassa (esimerkiksi haja-asutusalueilla) / Muovipakkauksille ei ole pantillista palautusjärjestelmää.
Syitä, miksi toiset muovit soveltuvat paremmin ja toiset huonommin kierrätettäviksi (enintään 2 p.):
Esimerkiksi (1 p./seikka):
- Polymeerin yksinkertainen kemiallinen koostumus / rakenne helpottaa kierrättämistä.
- Kestomuoveja voidaan muokata kuumentamalla uudestaan, kertamuoveja ei.
- Kestomuovissa polymeeriketjujen välillä on heikkoja sidoksia, kertamuovissa vahvempia.
- Jotkut muovit / lisäaineet voivat vapauttaa myrkkyjä kierrätysprosessissa (esimerkiksi PVC).
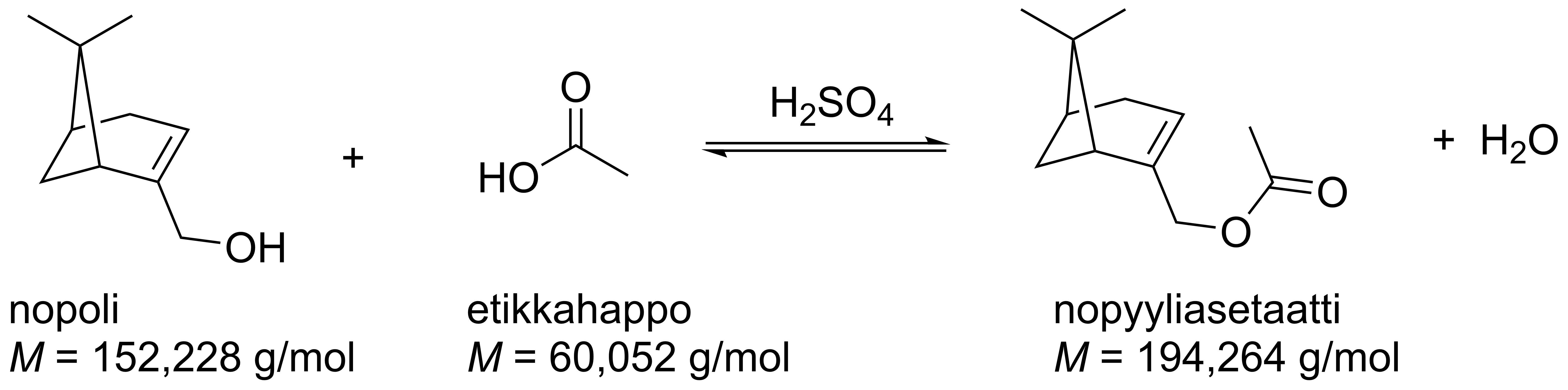
8. Hajuveden tuoksuaineen valmistusreaktio 15 p.
Nopyyliasetaatti on hajuvesissä käytetty aine, jonka tuoksu on hedelmäinen ja puinen. Nopyyliasetaattia voidaan valmistaa esimerkiksi kuvan esittämällä nopolin ja etikkahapon välisellä esteröintireaktiolla. Kuvassa on myös esitetty lähtöaineiden ja tuotteiden moolimassat. Käytä niitä tehtävänratkaisussa.
Eräässä kokeessa nopyyliasetaattia valmistettiin esteröintireaktiossa liuottamalla nopolia etikkahappoon. Nopolin massa oli 20,0 g ja etikkahapon 15,8 g. Reaktioseokseen lisättiin katalyytiksi rikkihappoa ja seos kuumennettiin 50 °C:n lämpötilaan. Reaktioseoksen kokonaistilavuus oli tällöin 26,4 ml.
8.1 Kun tasapaino oli saavutettu, nopyyliasetaatti eristettiin. Puhtaan ja eristetyn nopyyliasetaatin massa oli 15,1 g. Mikä oli nopyyliasetaatin prosentuaalinen saanto? 7 p.
n(nopoli) = m / M = 20,0 g / 152,228 g/mol = 0,13138 mol
n(etikkahappo) = 15,8 g / 60,052 g/mol = 0,26311 mol
(3 p.)
Pisteitys: yksi ainemäärä oikein, 2 p., molemmat oikein, 3 p.
Rajoittavan tekijän päättely:
Stoikiometristen kertoimien perusteella nopoli ja etikkahappo reagoivat keskenään ainemääräsuhteessa 1:1. (1 p.) Siten etikkahappoa on ylimäärin, ja nopoli on rajoittava tekijä. (1 p.)
- Jos rajoittava tekijä on valittu väärin, pisteiden kertyminen päättyy (ei-VSE).
- Jos rajoittavaa tekijää ei ole perusteltu mutta laskussa on jatkettu oikealla aineella, rajoittavan tekijän päättelypisteitä ei ansaita, mutta pisteiden kertyminen jatkuu (VSE).
Siten n(nopoli) = n(nopyyliasetaatti).
Nopyyliasetaatin teoreettinen saanto:
m(nopyyliasetaatti) = n(nopyyliasetaatti) · M(nopyyliasetaatti)
= 0,13138 mol · 194,264 g/mol = 25,523 g
(1 p.)
Prosentuaalinen saanto: 15,1 g / 25,523 g = 0,5916 \approx 59,2 %.
(1 p.)
Vastaus: Nopyyliasetaatin prosentuaalinen saanto oli 59,2 %.
8.2 Reaktion tasapainovakio 50 °C:n lämpötilassa on 2,90. Laske kaikkien yhdisteiden tasapainokonsentraatiot. 8 p.
c = n / V ja n = m / M.
Yhdistämällä yhtälöt saadaan: c = m / (M · V).
c(nopoli) = m / (M · V) = 20,0 g / (152,228 g/mol · 0,0264 dm³) = 4,9766 mol/l
(1 p.)
c(etikkahappo) = m / (M · V) = 15,8 g / (60,052 g/mol · 0,0264 dm³) = 9,9661 mol/l
(1 p.)
K=\frac{\mathrm{[nopyyliasetaatti]\cdot[vesi]}}{\mathrm{[nopoli]\cdot[etikkahappo]}}
(1 p.)
Tasapainotarkastelu:
| nopoli | + | etikkahappo | ⇌ | nopyyliasetaatti | vesi | |
| calku (mol/l) | 4,9767 | 9,9661 | 0 | 0 | ||
| ctasapaino (mol/l) | 4,9767–x | 9,9661–x | x | x |
(2 p.)
- Jos tasapainovakion lausekkeesta tai tasapainon laskennallisesta käsittelystä (esimerkiksi taulukosta tai sijoituksesta) puuttuu jokin aine (esimerkiksi vesi), osatehtävästä voi ansaita korkeintaan 2 p. alkukonsentraatioista.
- Jos tehtävä on ratkaistu ainemäärillä konsentraatioiden sijaan, pitää perustella, että tilavuudet supistuvat pois tasapainovakion lausekkeesta, muuten vähennetään −2 p. osatehtävästä.
2,90 = x² / [(4,9767 – x) · (9,9661 – x)]
x = 4,0319 (tai x = 18,7753)
(1 p.)
Koska konsentraatioiden on oltava positiivisia, valitaan x = 4,0319.
Tasapainokonsentraatiot: (2 p.)
c(nopoli) = 4,9767 mol/l – 4,0320 mol/l = 0,9447 mol/l \approx 0,945 mol/l
c(etikkahappo) = 9,9661 mol/l – 4,0320 mol/l = 5,9341 mol/l \approx 5,93 mol/l
c(nopyyliasetaatti) = c(vesi) = 4,0320 mol/l \approx 4,03 mol/l
Pisteitys: kaksi konsentraatiota oikein, 1 p., loput kaksi konsentraatiota oikein 1 p. (yhteensä 2 p.)
Vastaus:
c(nopoli) = 0,945 mol/l
c(etikkahappo) = 5,93 mol/l
c(nopyyliasetaatti) = c(vesi) = 4,03 mol/l
Osa 3: 20 pisteen tehtävät
9. Litiumioniakun ylikuumeneminen 20 p.
Litiumioniakkuja käytetään yleisesti ladattavassa elektroniikassa ja sähköautoissa. Akkuja voidaan valmistaa käyttämällä erilaisia kemiallisia yhdisteitä. Yleisesti anodimateriaalina käytetään litiumkobolttioksidia LiCoO₂, katodimateriaalina grafiittia sekä elektrolyyttinä jotakin orgaanista ainetta ja suoloja, jotka mahdollistavat litiumionien liikkeen. Akun lataamisen kokonaisreaktio on
LiCoO₂(s) → Li(s) + CoO₂(s).
Alkuainemuodossa oleva litium kiinnittyy grafiittielektrodin pinnalle.
9.1 Miksi litiumioniakussa ei voi käyttää vesiliuosta elektrolyyttinä? 3 p.
Alkuainemuodossa oleva litium reagoi veden kanssa (2 p.) (ja hapettuu välittömästi).
Perustelu tai tarkennus, 1 p., esimerkiksi:
- Litium on alkalimetalli (ja siten reaktiivinen)
- Litium hapettuu voimakkaasti
- Litium on vahva pelkistin
- Litium reagoi voimakkaasti/kiivaasti
- Reaktio on (hyvin) eksoterminen/vapauttaa (runsaasti) lämpöä
Vaihtoehtoinen vastaustapa:
(Ladattaessa) vesi pelkistyisi litiumin sijasta. (2 p.)
Perustelu normaalipotentiaalien avulla (1 p.)
9.2 Kun litiumkobolttioksidia kuumennetaan, se alkaa hajota ja muodostaa kiinteää litiumoksidia, kiinteää koboltti(II)oksidia ja happea. Kirjoita hajoamisreaktion reaktioyhtälö. Laske LiCoO₂:n hajoamisreaktion reaktioentalpia käyttäen taulukossa annettuja muodostumisentalpioita. 6 p.
Reaktioyhtälö on:
4LiCoO₂(s) → 2Li₂O(s) + 4CoO(s) + O₂(g).
(3 p.)
Pisteitys: kaikki aineet oikein, 1 p., kertoimet oikein 1 p., olomuodot oikein 1 p. Kertoimien ja olomuotojen pisteet voi ansaita vain, jos aineet ovat oikein.
- Jos reaktiossa on kerroinvirhe tai virheellisiä aineita, entalpialaskusta ei voi ansaita pisteitä (ei-VSE).
Reaktioentalpia on
∆Hr(hajoamisreaktio)
= 2 · ∆Hf(Li₂O) + 4 · ∆Hf(CoO) + ∆Hf(O₂) – 4 · ∆Hf(LiCoO₂)
(1 p.)
= 2 · (–595,8 kJ/mol) + 4 · (–237,7 kJ/mol) + (0 kJ/mol) – 4 · (–679,4 kJ/mol)
(1 p.)
= 575,2 kJ/mol.
(1 p.)
- Yksikkönä hyväksytään kJ/mol tai kJ (myös J/mol tai J).
- Jos yksikkö puuttuu tai on väärin, −1 p.
9.3
LiCoO₂:n hajoamisreaktiossa vapautunut happi voi reagoida edelleen elektrolyytin orgaanisten aineiden kanssa. Tällainen aine on esimerkiksi etyleenikarbonaatti C₃H₄O₃. Sen palamisreaktio on
2C₃H₄O₃(s/l) + 5O₂(g) → 6CO₂(g) + 4H₂O(g). ∆Hr = –4 510 kJ/mol
Hyödynnä etyleenikarbonaatin palamisreaktiota sekä osatehtävässä 9.2 kirjoittamaasi LiCoO₂:n hajoamisreaktiota ja kirjoita reaktioyhtälö kokonaisreaktiolle LiCoO₂:n ja etyleenikarbonaatin välillä. Oletetaan, että lämpötila on niin korkea, että litiumkobolttioksidi hajoaa osatehtävässä 9.2 kuvatulla tavalla. Reaktioyhtälössä voi käyttää molekyylikaavoja.
Laske lisäksi kokonaisreaktion reaktioentalpia.
6 p.Kokonaisreaktio:
10LiCoO₂(s) + C₃H₄O₃(s/l) → 5Li₂O(s) + 10CoO(s) + 3CO₂(g) + 2H₂O(g)
(3 p.)
Kokonaisreaktion pisteitys: kaikki aineet oikein, 1 p., jos lisäksi kertoimet oikein, 2 p.
- Jos reaktiossa on kerroinvirhe tai virheellisiä aineita, entalpialaskusta ei voi ansaita pisteitä (ei-VSE).
Kokonaisreaktion reaktioentalpia on
∆Hr(kokonaisreaktio) = (5 · ∆Hr(hajoamisreaktio) + ∆Hr(palamisreaktio))/2
= (5 · (575,2 kJ/mol) + (–4 510 kJ/mol))/2
(1 p.)
= –817 kJ/mol.
(2 p.)
- Yksikkönä hyväksytään kJ/mol tai kJ (myös J/mol tai J).
- Jos yksikkö puuttuu tai on väärin, −1 p.
9.4 Vikaantuessaan litiumioniakku voi kuumentua liikaa. Tällainen vika voi syntyä esimerkiksi akun varaustilaa valvovan virtapiirin toimintahäiriöstä. Pohdi, miksi litiumioniakun kuumeneminen voi johtaa hyvin vaaralliseen tilanteeseen. 5 p.
Kuumentuessaan litiumkobolttioksidi alkaa vapauttaa happea. (2 p.)
- Kun lisäksi on tunnistettu, että vapautunut happi voi reagoida elektrolyytin kanssa, voi saada 1 p. lisää.
Muita huomioita, joista yhteensä korkeintaan 3 p:
- Kaasujen muodostumisen tai eksotermisen reaktion takia akku puhkeaa / räjähtää. (1 p.)
- Lisäksi tunnistettu, että ilmassa oleva happi tällöin reagoi litiumin tai elektrolyytin kanssa (1 p.).
- Akku syttyy palamaan tai aiheuttaa tulipalon (edellyttää, että tulen syttyminen liitetty akkuun tai akussa tapahtuvaan reaktioon). (1 p.) (Pelkkä toteamus, että tulipalo syttyy, ei siis riitä pisteisiin.)
- Akkupaloa on hankala sammuttaa. (1 p.)
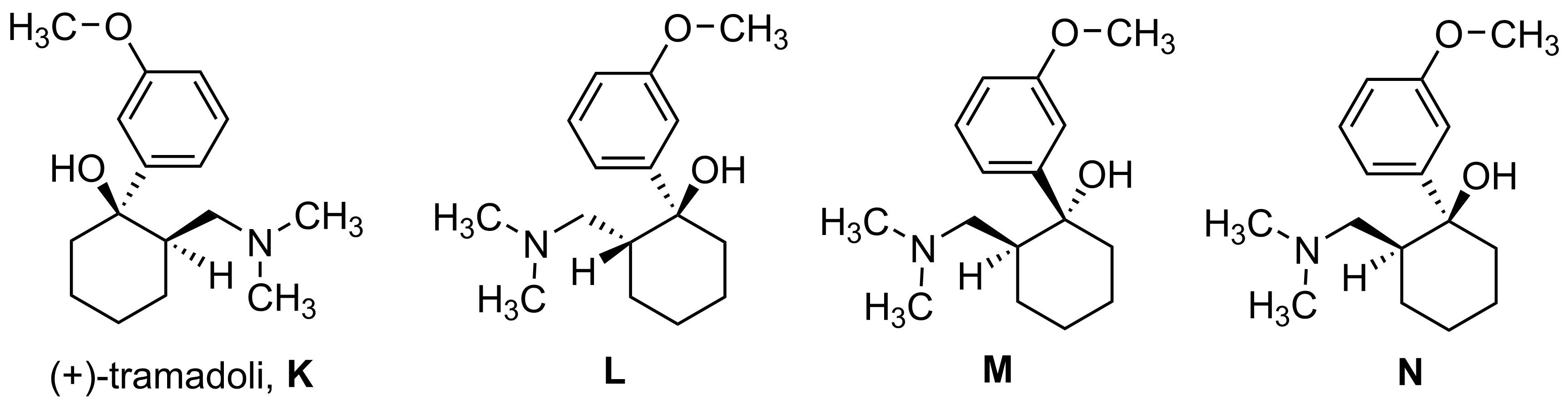
10. Kipulääkkeen arvoitus 20 p.
Tramadoli on 1970-luvulla markkinoille tullut synteettinen kipulääke. Tramadolia on kuitenkin löydetty myöhemmin myös Kamerunista, Afrikasta, Nauclea-suvun puiden juurista. Kyseessä saattaa olla ensimmäinen tapaus, jossa ihmisen tuottamaa lääkeainetta on löytynyt myös luonnosta. Sittemmin on kuitenkin esitetty todisteita, että tramadoli olisi sittenkin päätynyt puiden juuriin karjan ulosteiden ja virtsan mukana eikä se olisikaan luonnonaine.
Voit hyödyntää aineistoa vastatessasi osatehtäviin.
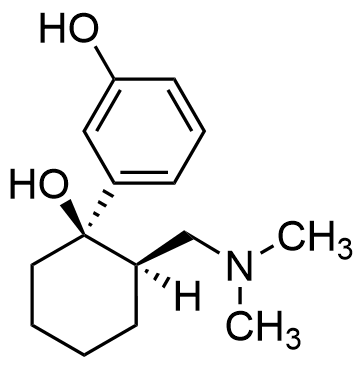
10.1 Tramadoli reagoi happojen kanssa siten, että reaktion tuotteena on suola. Mikä tramadolin funktionaalinen ryhmä tällöin reagoi? Esitä (+)-tramadolin (K) ja vetykloridin (HCl) muodostaman suolan rakennekaava. 4 p.
Aminoryhmä reagoi. (1 p.)
- Ei hyväksytä: amiiniryhmä / amiini
Suolan rakennekaava (3 p.)
- Pienet virheet, −1 p., kuten
- yksittäinen vetyatomi puuttuu muualta kuin funktionaalisista ryhmistä
- OH tai NH sitoutuu väärinpäin (sidos vetyatomiin).
- Merkittävät virheet, −2 p., kuten
- suolan +-varaus on merkitty väärän atomin kohdalle
- metyyliryhmä puuttuu protonoidusta aminoryhmästä.
- 0 p. rakenteesta esimerkiksi, kun:
- kloridi-ioni puuttuu
- kovalenttinen sidos aminoryhmän ja kloridi-ionin välillä
- valenssivirheet (esimerkiksi hiiliatomiin piirretty viisi sidosta).
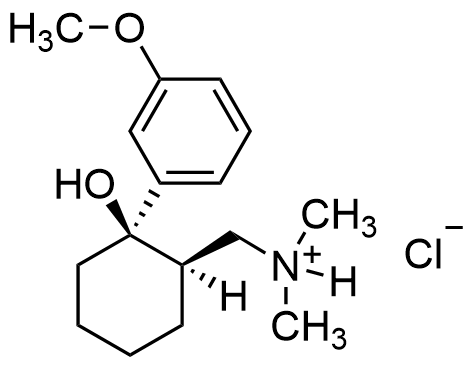 Muodostuneen suolan rakenne
Muodostuneen suolan rakenne
10.2 (+)-Tramadoli (K) voi reagoida eliminaatioreaktiossa, jolloin syntyy kaksi eri isomeeriä. Esitä näiden isomeerien rakennekaavat. 6 p.
3 p./isomeeri
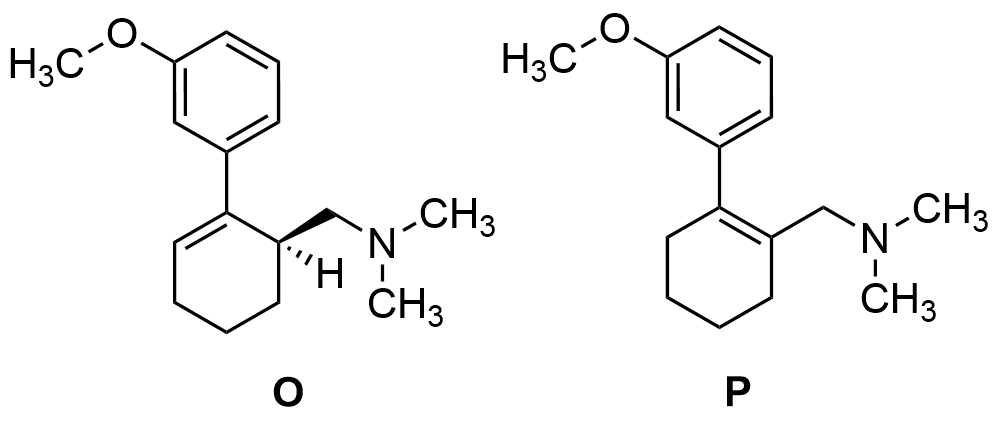 Oikeat isomeerit
Oikeat isomeerit
Stereokemian kuvausta ei vaadita rakenteesta O.
- Kaksoissidos merkitty väärään paikkaan, tai väärä ryhmä on eliminoitu, 0 p. rakenteesta.
- Jos yhden oikean rakenteen lisäksi on esitetty yksi väärä tuote, ei vähennystä, mutta jos kaksi tai useampaa väärää tuotetta, 0 p. osatehtävästä.
10.3 (+)-Tramadolin (K) eetteriryhmä hydrolysoituu elimistössä, jolloin syntyy yhdistettä, joka sisältää fenoliryhmän. Tämä yhdiste on jopa sata kertaa alkuperäistä lääkeainetta tehokkaampi kipulääke. Esitä tämän hajoamistuotteen rakennekaava. 4 p.
10.4
Tramadolin synteesissä syntyy isomeerien K ((+)-tramadoli), L, M ja N seos. Seoksesta erotetaan pois kaksi isomeeriä, minkä jälkeen jää jäljelle lääkkeen vaikuttava aine, joka on (+)- ja (−)-tramadolin muodostama rasemaatti (raseeminen seos). Selitä, mitä rasemaatti (raseeminen seos) tarkoittaa.
Mikä isomeereistä L, M tai N on (−)-tramadoli? Jos tramadolia syntyisi luonnossa, olisiko todennäköistä, että se esiintyisi rasemaattina?
6 p.
Raseeminen seos sisältää yhtä paljon (1:1, 50:50) molempia enantiomeerejä eli tässä tapauksessa (+)- ja (−)-tramadolia. (2 p.)
Pisteitys: sisältää molempia enantiomeerejä, 1 p., yhtä paljon, 1 p.
- Jos väärä isomerialaji on mainittu tai isomerialaji on tarkentamatta, 0 p.
Yhdiste N on (+)-tramadolin enantiomeeri. N:n täytyy olla (−)-tramadoli. (2 p.)
Luonnossa yhdisteet syntyvät (kiraalisten) entsyymien/proteiinien ohjaamana
TAI
entsyymit/proteiinit katalysoivat vain toisen enantiomeerin muodostumista (1 p.)
- Piste edellyttää, että entsyymi tai proteiini on mainittu vastauksessa.
Johtopäätös: ja siksi muodostuu vain toista enantiomeeriä. (1 p.)
- Johtopäätöksen piste ansaitaan vain, jos edellinen piste on ansaittu.
11. Infrapunaspektroskopia 20 p.
11.1
Sinulla on näyte, jonka tiedät koostuvan yhdestä puhtaasta yhdisteestä. Lisäksi tiedät, että tämä yhdiste on toinen kahdesta mahdollisesta yhdisteestä. Miten IR-spektroskopian avulla selvitetään, kumpaa yhdistettä näyte sisältää?
IR-spektroskopia ei välttämättä riitä molekyylin rakenteen yksiselitteiseen määrittämiseen. Nimeä jokin analyysimenetelmä, jolla saat lisätietoa tunnistamista varten. Analyysimenetelmän nimi riittää vastaukseksi.
6 p.
Mitataan tuntemattoman yhdisteen infrapunaspektri.
Yhdisteen selvittäminen, vaihtoehto 1, korkeintaan 4 p.:
Määritetään spektristä absorptiopiikkien (1 p.) aaltoluvut. (1 p.)
Tunnistetaan spektripiikkejä vastaavat funktionaaliset ryhmät taulukon avulla. (1 p.)
Verrataan kahden mahdollisen yhdisteen rakenteesta löytyviä funktionaalisia ryhmiä spektripiikkien avulla saatuun tietoon ja pyritään tunnistamaan näyte. (1 p.)
Yhdisteen selvittäminen, vaihtoehto 2, korkeintaan 4 p.:
Verrataan yhdisteestä mitattua spektriä vertailuaineen spektriin. (2 p.)
Tunnistetaan yhdiste spektrien vastaavuuden kautta. Spektrien absorptiopiikkien (1 p.) aaltoluvut (ja absorptiopiikkien muodot) vastaavat toisiaan. (1 p.)
Toisen analyysimenetelmän nimeäminen, 2 p.:
Jos IR-spektroskopia ei riitä yhdisteen tunnistamiseen, voidaan käyttää lisäksi esim. seuraavia analyysimenetelmiä: massaspektrometria, NMR, UV-vis (tai jokin muu soveltuva analyysimenetelmä). (2 p.)
- Erotusmenetelmiä tai muita menetelmiä, joilla ei saada lisätietoja tunnistamiseen ei hyväksytä, kuten esimerkiksi: uutto, sentrifugointi, tislaus, haihdutus, suodatus.
11.2 Kumman sidoksen värähdysten aaltoluku on suurempi, C–O-sidoksen vai C=O-sidoksen? Perustele. Voit hyödyntää vastauksessasi tekstiä . 4 p.
C=O-sidos on vahvempi kuin yksinkertainen C–O-sidos. (2 p.)
Tällöin C=O-sidoksen voimavakio on suurempi. (1 p.)
Siten C=O-sidoksen värähdysten aaltoluku on suurempi. (1 p.)
11.3 Myös molekyylien välisten sidosten värähdyksiä voidaan tutkia spektroskooppisesti. Ovatko molekyylien välisten sidosten värähtelyjen aaltoluvut pienemmät vai suuremmat kuin molekyylien sisäisten sidosten? Perustele. Voit hyödyntää vastauksessasi tekstiä . 4 p.
Molekyylien väliset sidokset ovat heikompia kuin molekyylien sisäiset sidokset (2 p.), joten niihin liittyvien sidosten voimavakiot ovat pienempiä (1 p.).
Molekyylien välisten sidosten värähtelyjen aaltoluvut ovat pienemmät kuin molekyylien sisäisten sidosten. (1 p.)
11.4
Vetykloridin (HCl) vety voidaan korvata vedyn raskaammalla isotoopilla, ²H:lla eli deuteriumilla. Deuteriumia merkitään molekyylikaavoissa myös kirjaimella D. Kaasumaisen HCl:n IR-spektrissä näkyvän absorption keskikohdan aaltoluku on \nu=2\ 890\ \mathrm{cm}^{-1}. DCl:n vastaava värähdyksen aaltoluku on \nu=2\ 090\ \mathrm{cm}^{-1}.
Hyödynnä tekstiä ja laske HCl:n ja DCl:n kokeellisten värähdysaaltolukujen suhde \left( \frac{\nu_{\mathrm{HCl}}} {\nu_{\mathrm{DCl}}} \right). Laske myös vastaava suhde harmonisen aaltoluvun lausekkeen avulla. Voit olettaa, että vedyn korvaaminen deuteriumilla ei vaikuta sidoksen voimavakioon.
6 p.
Kokeellisten aaltolukujen suhde
\frac{\nu_{\mathrm{HCl}}}{\nu_{\mathrm{DCl}}} = \frac{2890\ \mathrm{cm}^{-1}}{2090\ \mathrm{cm}^{-1}}\approx 1,38
(1 p.)
Atomien massat missä tahansa järkevissä yksiköissä
mH: 1,008 u / 1,008 Da / 1,008 g/mol
mD: 2,014 u / 2,014 Da / 2,014 g/mol
(Deuteriumin massana hyväksytään esimerkiksi mH + m(neutroni), mutta ei hyväksytä kemiallisesti väärää periaatetta, kuten 2 · mH)
mCl: 34,969 u / 34,969 Da / 34,969 g/mol (³⁵Cl:n massa, hyväksytään myös 35,45 u eli kloorin keskimääräinen moolimassa)
(2 p.)
Pisteitys: kaksi massaa oikein 1 p., kolmaskin massa oikein, 1 p. (yhteensä 2 p.).
Aaltolukujen suhde harmonisen aaltoluvun lausekkeen kautta:
\mu_{\mathrm{DCl}}=\frac{m_\mathrm{D}m_\mathrm{Cl}}{m_\mathrm{D}+m_\mathrm{Cl}}=\frac{2{,}014\ \mathrm{u}\cdot 34{,}969\ \mathrm{u}}{2{,}014\ \mathrm{u} + 34{,}969\ \mathrm{u}}=\frac{70{,}428\ \mathrm{u}}{36{,}983\ \mathrm{u}}
\mu_{\mathrm{HCl}}=\frac{m_{\mathrm{H}}m_{\mathrm{Cl}}}{m_{\mathrm{H}}+m_{\mathrm{Cl}}}=\frac{1{,}008\ \mathrm{u}\cdot34{,}969\ \mathrm{u}}{1{,}008\ \mathrm{u}+34{,}969\ \mathrm{u}}=\frac{35{,}249\ \mathrm{u}}{35{,}977\ \mathrm{u}}
(1 p.)
- Pisteeseen riittää oikeat suureyhtälöt.
\frac{\nu_{\mathrm{HCl}}}{\nu_{\mathrm{DCl}}}=\frac{\frac{1}{2\pi c}\sqrt{\frac{k_\mathrm{HCl}}{\mu_\mathrm{HCl}}}}{\frac{1}{2\pi c}\sqrt{\frac{k_\mathrm{DCl}}{\mu_\mathrm{DCl}}}}=\sqrt{\frac{\mu_\mathrm{DCl}}{\mu_\mathrm{HCl}}}
(1 p.)
\frac{\nu_{\mathrm{HCl}}}{\nu_{\mathrm{DCl}}}=\sqrt{\frac{\frac{70{,}428}{36{,}983}\mathrm{u}}{\frac{35{,}249}{35{,}977}\mathrm{u}}}=\sqrt{\frac{35{,}977\cdot 70{,}428}{35{,}249\cdot 36{,}983}}\approx 1{,}39
(1 p.)