Hyvän vastauksen piirteet: FI – Kemia
18.9.2024
Lopulliset hyvän vastauksen piirteet 14.11.2024
Lopullisista hyvän vastauksen piirteistä ilmenevät perusteet, joiden mukaan koesuorituksen lopullinen arvostelu on suoritettu. Tieto siitä, miten arvosteluperusteita on sovellettu kokelaan koesuoritukseen, muodostuu kokelaan koesuorituksestaan saamista pisteistä, lopullisista hyvän vastauksen piirteistä ja lautakunnan määräyksissä ja ohjeissa annetuista arvostelua koskevista määräyksistä. Lopulliset hyvän vastauksen piirteet eivät välttämättä sisällä ja kuvaa tehtävien kaikkia hyväksyttyjä vastausvaihtoehtoja tai hyväksytyn vastauksen kaikkia hyväksyttyjä yksityiskohtia. Koesuorituksessa mahdollisesti olevat arvostelumerkinnät katsotaan muistiinpanoluonteisiksi, eivätkä ne tai niiden puuttuminen näin ollen suoraan kerro arvosteluperusteiden soveltamisesta koesuoritukseen.
Ylioppilastutkinnon kokeessa selvitetään, ovatko opiskelijat omaksuneet lukion opetussuunnitelman mukaiset tiedot ja taidot sekä saavuttaneet lukiokoulutuksen tavoitteiden mukaisen riittävän kypsyyden. Kemian kokeessa arvioinnin kohteina ovat kemiallisen tiedon ymmärtäminen ja soveltaminen. Arvioinnissa otetaan huomioon myös kokeellisen tiedonhankinnan ja ‐käsittelyn taidot. Näihin kuuluvat esimerkiksi kokeiden suunnittelu, työvälineiden ja reagenssien turvallinen käyttö, tulosten esittäminen ja tulkitseminen sekä johtopäätösten tekeminen ja soveltaminen.
Kemian tehtäviä arvosteltaessa painotetaan oppiaineen luonteen mukaista esitystapaa sekä käsitteiden ja kielenkäytön täsmällisyyttä. Reaktioyhtälöt esitetään ilman hapetuslukuja pienimmin mahdollisin kokonaislukukertoimin ja olomuodoilla varustettuna. Orgaanisissa reaktioyhtälöissä käytetään rakennekaavoja, mutta olomuotoja ei tarvitse mainita. Rakennekaavojen eri esitystavat hyväksytään.
Laskennallisissa tehtävissä suureyhtälöjä ja kaavoja käytetään tavalla, joka osoittaa kokelaan ymmärtäneen tehtävänannon oikein ja soveltaneen ratkaisussaan asianmukaista periaatetta tai lakia. Vastauksesta ilmenee yksiselitteisesti, miten lopputulokseen päädytään, mutta laajoja välivaiheita ei tarvita. CAS-ohjelmia voi hyödyntää tehtävän eri vaiheissa. Merkintätapojen kannalta keskeisiä vaiheita ovat periaatteiden ja lakien sekä lopputuloksen ja johtopäätösten esittäminen. Lopputulokset annetaan lähtöarvojen mukaisella tarkkuudella yksiköineen ja johtopäätökset perustellaan.
Mittaustuloksia ja niistä piirrettyjä kuvaajia hyödynnetään tiedon analysoinnissa ja johtopäätösten tekemisessä. Mittauspisteisiin sovitetaan asianmukainen suora. Mittauspisteiden välisiä arvoja voi interpoloida kuvaajaa silmämääräisesti lukemalla tai sopivalla ohjelmalla. Kuvaajaan merkitään akselien nimet, yksiköt ja asteikko. Kuvaajaan merkitään johtopäätösten kannalta olennaiset kohdat, kuten titrauskäyrän ekvivalenttikohta tai hetkellistä nopeutta laskettaessa kyseinen tangentti.
Essee‐ ja selittävissä vastauksissa tekstiä täydennetään reaktioyhtälöillä, kaavoilla tai piirroksilla. Käsiteltäviä ilmiöitä kuvataan makroskooppisella, mikroskooppisella ja symbolisella tasolla. Vastauksesta ilmenee, että tehtävään liittyvää aineistoa on hyödynnetty, sovellettu, analysoitu ja arvioitu tehtävänannon mukaisesti. Hyvä vastaus on jäsennelty ja sisällöltään johdonmukainen.
Vastaus arvostellaan tehtäväkohtaisten kriteerien mukaisesti. Lähtökohtana ovat vastauksen ansiot, joista kertyy pisteitä. Jos keskeinen kemiallinen periaate puuttuu tai se on virheellinen, pisteiden kertyminen päättyy. Tällöin virheellisen tuloksen siirtymistä eteenpäin ei hyväksytä (ei-VSE). Tällaiset virheet ovat esimerkiksi stoikiometriavirheet, väärä rajoittava tekijä tai väärä aine reaktioyhtälössä. Muiden puutteiden tai virheiden tapauksessa virheellisen tuloksen siirtyminen eteenpäin hyväksytään (VSE), jolloin pisteiden kertyminen jatkuu puutteen tai virheen jälkeen. Kokeen osan 3 vaativat tehtävät edellyttävät täsmällisempää periaatteiden hallintaa kuin kokeen alkupään perustehtävät. Kemian kannalta epätäsmällisestä kielenkäytöstä, pienestä laskuvirheestä tai likiarvojen huolimattomasta käytöstä vähennetään 0–3 p. esimerkiksi seuraavasti:
- pyöristys- ja kopiointivirheet, jotka eivät vaikuta lopputulokseen, −0 p.
- kopiontivirheet, pyöristysvirheet ja pienet huolimattomuusvirheet, jotka vaikuttavat lopputulokseen, yksittäinen pieni virhe rakennekaavassa −1 p.
- yksikönmuunnosvirheet, systemaattinen virhe rakennekaavassa tai muut vähäistä suuremmat virheet, jossa ei kuitenkaan ole väärä kemiallinen periaate −2 p.
Osa 1: 20 pisteen tehtävä
1. Monivalintatehtäviä kemian eri osa-alueilta 20 p.
1.1 Laboratorion pöydällä on pullo, joka sisältää NaOH:n vesiliuosta. Haluat selvittää liuoksen konsentraation. Mikä seuraavista tekniikoista soveltuu tähän? 2 p.
- titraus (2 p.)
1.2 Mikä seuraavista alkuainepareista voi muodostaa kovalenttisen sidoksen? 2 p.
- vety ja hiili (2 p.)
1.3 Autonrenkaan kokonaispaine on 3,00 bar, kun ilman lämpötila on 10°C. Seuraavana päivänä lämpötila on 20°C. Mikä on tällöin rengaspaine? Oletetaan, että renkaan tilavuus ei muutu. 2 p.
- 2,90 bar (2 p.)
- 3,11 bar (2 p.)
1.4
Reaktoriin on johdettu kaasumaiset lähtöaineet A ja B, jotka reagoivat tuotteeksi C seuraavan reaktioyhtälön mukaan:
A(g) + B(g) → C(g).
Mikä seuraavista toimenpiteistä EI kasvata tuotteen muodostumisnopeutta?
2 p.
- Reaktorin paineen nostaminen johtamalla reaktoriin inerttiä kaasua kuten argonia. (2 p.)
1.5 Kuvaajassa on esitetty kemiallisen reaktion lähtöaineen, välituotteen sekä lopputuotteen konsentraatioiden muutokset ajan funktiona. Mikä seuraavista väitteistä on tosi? 2 p.
- A on välituote, B on lopputuote ja C on lähtöaine. (2 p.)
1.6 Missä seuraavista yhdisteistä on ionisidos? 2 p.
- NH₄Cl (2 p.)
1.7
Erään galvaanisen kennon kennokaavio on
−Fe(s) | Fe²⁺(aq) || Au⁺(aq) | Au(s) +.
Mikä on tämän kennon lähdejännite?
2 p.
−Fe(s) | Fe²⁺(aq) || Au⁺(aq) | Au(s) +.
- 2,14 V (2 p.)
1.8 Heliumkaasua kuumennetaan ilmapallossa siten, että sen paine ei muutu. Tällöin heliumin 2 p.
- tilavuus kasvaa. (2 p.)
1.9 Mikä seuraavista on elektroniikkateollisuudessa käytetty puolimetalli? 2 p.
- pii (2 p.)
1.10 Tutkija haluaa selvittää tuntemattoman orgaanisen yhdisteen sitoutumista. Häntä kiinnostavat atomien kiinnittyminen toisiinsa ja hiilivetyrungon haaroittuneisuus. Mitä seuraavista tutkimusmenetelmistä tutkijan kannattaa hyödyntää, jotta hän saisi parhaiten vastauksia tutkimusongelmaansa? 2 p.
- NMR-spektroskopia (2 p.)
Osa 2: 15 pisteen tehtävät
2. Jaksollinen järjestelmä ja alkuaineiden ominaisuuksia 15 p.
Täydennä seuraavat virkkeet puuttuvilla sanoilla tai luvuilla. Kuhunkin kohtaan tulee korkeintaan kaksi sanaa tai lukua.
Alkuaineiden jaksollinen järjestelmä sekä alkuaineiden nimet ja symbolit löytyvät koeympäristön ohjeesta.
2.1 Alkuaineiden jaksollisen järjestelmän perustermejä 4 p.
2.1.1 1 p.
- järjestysluvun (1 p.)
- protoniluvun (1 p.)
2.1.2 1 p.
- atomimassa (1 p.)
2.1.3 1 p.
- jaksoiksi (1 p.)
- periodeiksi (1 p.)
2.1.4 1 p.
- ryhmiä (1 p.)
2.2 Alkuaineiden ominaisuuksia 5 p.
2.2.1 1 p.
- alkalimetalleiksi (1 p.)
2.2.2 1 p.
- radioaktiivisia (1 p.)
- epävakaita (1 p.)
2.2.3 1 p.
- hiilimonoksidi (1 p.)
2.2.4 1 p.
- happaman (1 p.)
2.2.5 1 p.
- +2 (1 p.)
2.3 Jaksollisia ominaisuuksia 6 p.
2.3.1 1 p.
- elektronegatiivisuus (1 p.)
- tehollinen ydinvaraus (1 p.)
2.3.2 1 p.
- oikeassa (1 p.)
2.3.3 1 p.
- ionisaatioenergia (1 p.)
2.3.4 1 p.
- pienemmäksi (1 p.)
2.3.5 1 p.
- isommaksi (1 p.)
2.3.6 1 p.
- pienenee (1 p.)
Myös muut oikeat ilmaisut hyväksytään. Pienistä kirjoitusvirheistä ei tehdä vähennyksiä.
3. Arkielämän ilmiöitä 15 p.
3.1 Miksi jääkaapissa säilytettyyn virvoitusjuomapulloon muodostuu avattaessa poreita, kuten oheisessa kuvassa? Kirjoita myös ilmiötä kuvaava reaktioyhtälö. 5 p.
Virvoitusjuomapullot sisältävät hiilihappoa/hiilidioksidia.
(1 p.)
-
Jos oikean aineen lisäksi mainittu väärä aine, 0 p.
Kun juomapullo avataan, paine pullon sisällä pienenee / muodostuu avoin systeemi, joka ei ole enää tasapainossa ja hiilidioksidin liukoisuus pienenee / tasapaino siirtyy kaasumaisen hiilidioksidin suuntaan.
(1 p.)
Tällöin juoman sisältämää hiilidioksidia/hiilihappoa vapautuu hiilidioksidikaasuna, mikä havaitaan poreiluna.
(1 p.)
-
Jos oikean kaasun lisäksi mainittu väärä kaasu, 0 p.
H₂CO₃(aq) → H₂O(l) + CO₂(g)
TAI
CO₂(aq) → CO₂(g)
(2 p.)
-
Oikeat aineet ja kertoimet 1 p., oikeat olomuodot 1 p. Olomuotopisteen voi ansaita vain jos aineet ja kertoimet ovat oikein.
3.2 Miksi saippuan avulla pystytään poistamaan rasvatahra? Perustele vastauksesi saippuan kemiallisen rakenteen avulla. Voit hyödyntää vastauksessasi oheisen kuvan natriumpalmitaatin rakennekaavaa. 5 p.
(Saippua koostuu rasvahappojen natrium- tai kaliumsuoloista.) Saippuan natrium- ja kaliumsuolat sisältävät rasvaliukoisen/poolittoman hiilivetyketjun
(1 p.)
ja vesiliukoisen/poolisen karboksyyliosan.
(1 p.)
-
Pisteiden ansaitseminen edellyttää, että pooliton ja poolinen osa on kohdistettu oikein
Saippuan rasvaliukoinen/pooliton osa kiinnittyy rasvatahraan dispersiovoimilla.
(1 p.)
Saippuan vesiliukoinen/poolinen pää muodostaa vetysidoksia veden kanssa.
(1 p.)
Kun saippuamolekyylejä on paljon, niiden pooliset päät / karboksyyliosat muodostavat misellin / pallomaisen rakenteen, jossa pooliset päät muodostavat ulkopinnan.
TAI
Vesi voi huuhtoa rasvatahran huuhteluveden mukana pois.
(1 p.)
-
Viimeisen pisteen voi ansaita vain jos jonkun osatehtävän aiemmista pisteistä on ansainnut.
3.3 Rasvat koostuvat rasvahappojen estereistä. Tyydyttyneet rasvat ovat usein huoneenlämpötiloissa kiinteitä ja tyydyttymättömät rasvat nestemäisiä. Selitä, mistä tämä ero johtuu. Voit hyödyntää vastauksessasi oheista kuvaa, jossa on esitetty tyydyttyneen rasvahapon (steariinihappo) ja tyydyttymättömän rasvahapon (oleiinihappo eli öljyhappo) rakennekaavat. 5 p.
Tyydyttymättömissä rasvoissa / oleiinihapossa on hiiliatomien välisiä kaksoissidoksia.
TAI
Tyydyttyneissä rasvoissa / steariinihapossa ei ole hiiliatomien välisiä kaksoissidoksia.
(1 p.)
-
Jos vastaus perustuu kolmoissidokseen tai C=O -kaksoissidokseen, pisteiden kertyminen päättyy.
-
Jos vastaus perustuu sekä kaksois- että kolmoissidokseen, rakenteen tarkasteluun liittyvät 3 p. voi ansaita, mutta tämän jälkeen pisteiden kertyminen päättyy. Tällöin osatehtävän kahta viimeistä pistettä ei ansaita.
Siksi tyydyttymättömien rasvojen hiilivetyketjut ovat taipuneita ja molekyylit eivät pääse lähelle toisiaan.
TAI
Tällöin tyydyttyneiden rasvamolekyylien hiilivetyketjut ovat suoria. Tyydyttyneiden rasvojen molekyylit pääsevät lähelle toisiaan.
(1 p.)
Tyydyttymätön nestemäinen rasva / oleiinihappo on rakenteeltaan cis/Z-isomeeri.
(1 p.)
Suorien hiilivetyketjujen välille muodostuu enemmän dispersiovoimia kuin taipuneiden hiilivetyketjujen välille.
(1 p.)
Tämän vuoksi tyydyttyneiden rasvojen sulamispisteet ovat korkeampia kuin tyydyttymättömien rasvojen.
TAI
Tyydyttyneiden rasvojen molekyylien välisten dispersiovoimien katkeamiseen tarvitaan enemmän energiaa.
(1 p.)
-
Viimeisen pisteen voi ansaita vain mikäli edellisen pisteen on ansainnut (dispersiovoimien vertailu).
4. Parkinsonin tautiin liittyviä yhdisteitä 15 p.
4.1 Nimeä rotigotiinin funktionaaliset ryhmät, joissa on typpi- tai happiatomi. 2 p.
Typpiatomin sisältävä funktionaalinen ryhmä on (tertiäärinen) aminoryhmä.
(1 p.)
-
"Amiiniryhmä" 0 p.
Happiatomi taas sisältyy fenoliseen hydroksiryhmään / fenoliseen hydroksyyliryhmään.
(1 p.)
-
Jos vastauksessa on mainittu enemmän kuin kaksi funktionaalista ryhmää, jokainen ylimääräinen ryhmä kumoaa oikeasta ryhmästä ansaitut pisteet. Pelkän hydroksiryhmän tai bentseenirenkaan mainitsemisesta ei tehdä vähennystä.
4.2 Esiintyykö rotigotiinilla konformaatioisomeriaa tai enantiomeriaa (peilikuvaisomeriaa / optista isomeriaa)? Perustele vastauksesi. Voit hyödyntää vastauksessasi tiedostoa . 5 p.
Rotigotiinissa esiintyy konformaatioisomeriaa,
(1 p.)
koska siinä on yksinkertaisia C–C / C–N / C–O -sidoksia, jotka voivat kiertyä.
(1 p.)
-
Piste edellyttää, että yksinkertainen sidos on kohdistettu oikeiden alkuaineiden välille.
-
Pisteen voi ansaita vain, jos oikea isomerian laji on tunnistettu.
Rotigotiinissa esiintyy enantiomeriaa,
(1 p.)
koska siinä on asymmetrinen hiiliatomi,
(1 p.)
joka on merkitty rakenteeseen tähdellä. (Myös sanallinen kohdistus oikeaan hiiliatomiin hyväksytään.)
(1 p.)
-
Kaksi jälkimmäistä pistettä voi ansaita vain, jos oikea isomerian laji on tunnistettu.
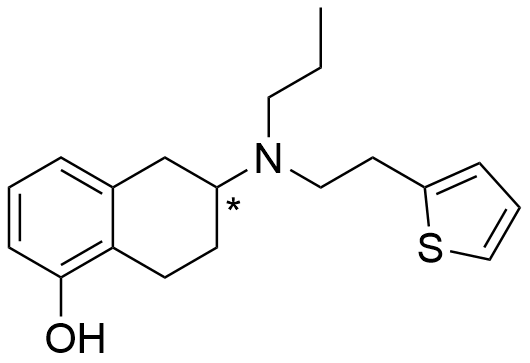 Rotigotiinin rakenne, johon on merkitty asymmetrinen hiiliatomi.
Rotigotiinin rakenne, johon on merkitty asymmetrinen hiiliatomi.
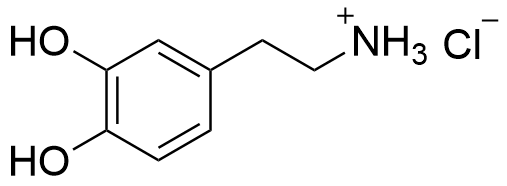
4.3 Piirrä rakennekaava suolasta, joka muodostuu, kun dopamiini reagoi vetykloridin (HCl) kanssa. Voit hyödyntää vastauksessasi tiedostoa . 4 p.
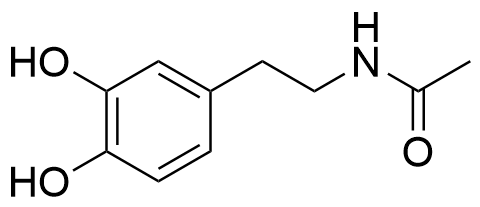
4.4 Eräässä lääkekehitysprojektissa tutkittiin dopamiinin amidijohdannaisten biologisia vaikutuksia. Yhdisteet valmistettiin dopamiinin ja erilaisten karboksyylihappojen välisillä kondensaatioreaktioilla. Esitä rakennekaava yhdisteestä, joka muodostuu, kun dopamiini reagoi etikkahapon (etaanihapon) kanssa muodostaen amidin. Voit hyödyntää vastauksessasi tiedostoa . 4 p.
5. Sotalaivan kunnostus 15 p.
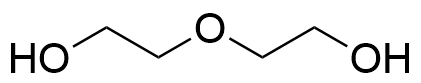
5.1 Piirrä PEG-molekyylin rakenne kahden toistuvan yksikön mittaisena (n = 2). Mikä funktionaalinen ryhmä on rakenteen keskellä? 4 p.
5.2 Aineistossa on esitetty selluloosan rakennekaava. Millä sidoksilla PEG-molekyylit sitoutuvat runkomateriaalin selluloosamolekyyleihin? Miten nämä sidokset muodostuvat PEG-molekyylien ja selluloosamolekyylien välille? 6 p.
Pistekertymä voi syntyä eri tavoin. Pistekertymä (enintään 6 p.) voi koostua seuraavista ansioista:
-
Jos PEG- ja selluloosamolekyylien välille muodostuviksi sidoksiksi on mainittu tai piirretty muita kuin vetysidoksia, dipoli-dipolisidoksia tai dispersiovoimia, koko osatehtävästä tulee 0 p.
PEG- ja selluloosamolekyylien välille muodostuu vetysidoksia.
(1 p.)
Vetysidos on kohdistettu hapen ja OH-ryhmän vedyn välille.
(1 p.)
Yksittäinen vetysidos voi syntyä PEG-molekyylin eetteriryhmän happiatomin ja selluloosan –OH-ryhmän vetyatomin välille, PEG-molekyylin OH-ryhmän ja selluloosan eetteriryhmän/asetaaliryhmän happiatomin välille ja PEG-molekyylin OH-ryhmän ja selluloosan OH-ryhmän välille.
(4 p.)
-
Jos yksi vetysidos kohdistettu oikein, 2 p., jos kaksi kohdistettu oikein, 3 p. ja jos kaikki kolme kohdistettu oikein 4 p.
Selluloosamolekyylin hydroksiryhmien O–H-sidokset ovat poolisia.
TAI
Sidoksen happi saa negatiivisen ja vety positiivisen osittaisvarauksen.
(1 p.)
PEG-molekyylien eetterihapessa on negatiivinen osittaisvaraus, koska C–O-sidos on poolinen / C–O-sidoksen happi on elektronegatiivisempi kuin hiili.
TAI
PEG-molekyylien eetterihapessa on vapaa elektronipari.
(1 p.)
PEG- ja selluloosamolekyylien välille muodostuu myös dispersiovoimia.
(1 p.)
Vastauksessa on kuvattu, miten dispersiovoimat syntyvät.
(1 p.)
5.3 Aineistossa on esitetty selluloosan ja tärkkelyksen yhden muodon (amyloosin) rakennekaavat. Vertaa selluloosan ja tärkkelyksen rakenteita ja kuvaile keskeiset erot. Perustele rakenteiden avulla, miksi selluloosa on puun keskeinen kuitumainen ainesosa. Miksi tärkkelys ei muodosta kuituja? 5 p.
Tärkkelys muodostaa kierteisen rakenteen
(1 p.)
ja selluloosa suoran rakenteen.
(1 p.)
Ero johtuu glykosidisidoksen suuntautumisesta: tärkkelyksessä glykosidisidos osoittaa kuusirenkaan tasosta poispäin, mutta selluloosassa se on renkaan tasossa.
(1 p.)
-
Glykosidisidosta ei tarvitse terminä mainita, mutta oikea rakenne pitää tunnistaa.
Selluloosamolekyylin välille syntyy vetysidoksia / dipoli-dipolisidoksia.
(1 p.)
Koska selluloosamolekyylit muodostavat suoran rakenteen, molekyylit voivat sitoutua toistensa lähelle (vetysidoksilla).
TAI
Koska amyloosimolekyylit ovat kierteisiä, molekyylit eivät pääse sitoutumaan yhtä lähelle toisiaan kuin selluloosamolekyylit. Tällöin ei synny kuitumaista rakennetta.
(1 p.)
6. Typen kierto luonnossa 15 p.
6.1 Määritä typen hapetusluvut (hapetusasteet) seuraavissa molekyyleissä tai ioneissa: 5 p.
6.1.1 1 p.
- 0 (1 p.)
6.1.2 1 p.
- –3 (1 p.)
6.1.3 1 p.
- –3 (1 p.)
6.1.4 1 p.
- +3 (1 p.)
6.1.5 1 p.
- +5 (1 p.)
Hapetusluvut hyväksytään arabialaisilla ja roomalaisilla numeroilla sekä tekstinä. Pienistä kirjoitusvirheistä ei tehdä vähennyksiä.
6.2 Tutustu aineistoihin ja . Anammox-reaktiossa nitriitti-ioni reagoi ammoniumionin kanssa, jolloin muodostuu typpikaasua ja nestemäistä vettä. Kirjoita anammox-reaktion reaktioyhtälö ja laske tämän reaktion reaktioentalpia. Käytä taulukon muodostumisentalpia-arvoja. Tehtävässä oletetaan, että ionit ovat vesiliuoksessa. 7 p.
Reaktio on
NO₂⁻(aq) + NH₄⁺(aq) → N₂(g) + 2H₂O(l).
(3 p.)
-
Oikeat aineet 1 p., oikeat kertoimet 1 p. ja oikeat olomuodot, 1 p.
-
Jos reaktioyhtälössä on vääriä aineita, 0 p. koko osatehtävästä.
-
Jos reaktioyhtälössä on väärä stoikiometria, kerroinpiste ja entalpialaskun pisteet menetetään.
Reaktioentalpia ΔHr saadaan laskettua yhtälöllä
ΔHr = ∑(ΔHf(tuotteet)) − ∑(ΔHf(lähtöaineet)).
ΔHr = ΔHf(N₂(g)) + 2 · ΔHf(H₂O(l)) −[ΔHf(NO₂⁻(aq)) + ΔHf(NH₄⁺(aq))]
(1 p.)
= [0,0 + 2 · (−285,8)] kJ/mol − [−100,0 + (−133,1)] kJ/mol
(1 p.)
-
Mikäli entalpia-arvojen etumerkit ovat väärin, 0 p. ja pisteiden kertyminen päättyy.
= −338,5 kJ/mol
(2 p.)
6.3 Typensitojabakteereissa on yleensä nitrogenaasientsyymejä. Nitrogenaasientsyymit mahdollistavat typen sidonnan ilmasta. Miksi typpimolekyylien sitominen ammoniakkina tai ammoniumionina edellyttää entsyymejä? 3 p.
Typpimolekyylissä on (vahva) kolmoissidos.
(1 p.)
Typpimolekyyli on hyvin pysyvä molekyyli / typensidonnan aktivaatioenergia on suuri / typpimolekyylin kolmoissidoksen katkaiseminen vaatii paljon energiaa.
(1 p.)
Entsyymi on katalyytti, joka vähentää aktivaatioenergiaa / nopeuttaa reaktiota.
(1 p.)
7. Bentsoehapon titraus 15 p.
7.1
Bentsoehappoliuoksen tilavuus oli 25,0 ml. Se titrattiin natriumhydroksidiliuoksella, jonka konsentraatio oli 0,050 mol/l. Natriumhydroksidin kulutus titrauksessa oli 11,3 ml. Titrauksen aikana pH-arvo mitattiin pH-mittarilla. Bentsoehapon happovakio on Ka = 6,28 · 10⁻⁵ (mol/l). Bentsoehapon rakenne on esitetty oheisessa kuvassa.
Laske liuoksen pH titrauksen ekvivalenttipisteessä yhden desimaalin tarkkuudella, (t = 25 °C).
12 p.
Titrausreaktio:
C₆H₅COOH(aq) + NaOH(aq) → C₆H₅COO⁻(aq) + Na⁺(aq) + H₂O(l)
-
Reaktioyhtälöä ei vaadita.
n(NaOH) = c(NaOH) · V(NaOH) = 0,050 mol/l · 0,0113 l = 0,000565 mol
(1 p.)
Titrausreaktioyhtälön kertoimista voidaan päätellä, että
n(C₆H₅COO⁻) = n(NaOH)
(2 p.)
c(C₆H₅COO⁻) = n(C₆H₅COO⁻) / V = 0,000565 mol / (0,0250 l + 0,0113 l) = 0,0155647 mol/l.
(1 p.)
-
Jos kokonaistilavuutta ei ole oikealla tavalla huomioitu laskussa päättyy pisteiden kertyminen. Tällöin voi silti ansaita pisteet emäsvakion arvon laskusta ja emäsvakion lausekkeesta.
Bentsoaatti-ioni protolysoituu liuoksessa:
C₆H₅COO⁻(aq) + H₂O(l) ⇌ C₆H₅COOH(aq) + OH⁻(aq).
Tasapainotarkastelu:
| C₆H₅COO⁻(aq) | + H₂O(l) | ⇌ | C₆H₅COOH(aq) | + OH⁻(aq) | |
|---|---|---|---|---|---|
| alussa [mol/l] | 0,0155647 | – | 0 | 0 | |
| muutos [mol/l] | −x | – | +x | +x | |
| tasapainossa [mol/l] | 0,0155647 − x | – | x | x |
(2 p.)
-
Jos tasapainotilanne on hahmoteltu virheellisesti päättyy pisteiden kertyminen.
Kb = Kw / Ka = (1,008 · 10⁻¹⁴ (mol/l)²) / (6,28 · 10⁻⁵ mol/l) = 1,6050955 · 10⁻¹⁰ mol/l
(1 p.)
Kb = [C₆H₅COOH] · [OH⁻] / [C₆H₅COO⁻]
(1 p.)
= x² / (0,0155647 – x) = 1,6050955 · 10⁻¹⁰
(1 p.)
x = 1,58052 ·10⁻⁶ mol/l (tai −1,58068 · 10⁻⁶ mol/l).
(1 p.)
(Hylätään negatiivinen juuri, koska konsentraatio ei voi olla negatiivinen.)
[OH–] = 1,58052 · 10⁻⁶ mol/l
pOH = –log₁₀[OH–] = 5,8012
(1 p.)
pH = 14,0 − 5,8012 = 8,1988 ≈ 8,2
(1 p.)
7.2 Nimeä jokin muuntyyppinen titraus ja kerro, mihin titrauksen ekvivalenttipisteen havaitseminen perustuu nimeämässäsi titrauksessa. 3 p.
Vastauksessa vaaditaan yksi menetelmä (1 p.) ja selitys siitä, miten ekvivalenttipiste havaitaan (2 p.).
Esimerkiksi:
-
Hapetus-pelkistystitraus, ekvivalenttipisteen havaitseminen perustuu hapettuvan tai pelkistyvän yhdisteen aiheuttamaan värin / jännitteen / pH:n muutokseen.
-
Saostustitraus, ekvivalenttipisteen havaitseminen perustuu saostuvan yhdisteen aiheuttamaan värinmuutokseen / jännitteen muutokseen / pH:n muutokseen / sakan muodostumisen loppumiseen.
-
Kompleksometrinen titraus, ekvivalenttipisteen havaitseminen perustuu muodostuvan tai hajoavan kompleksiyhdisteen aiheuttamaan värinmuutokseen.
-
Johtokykytitraus, ekvivalenttipisteen havaitseminen perustuu sähkönjohtokyvyn / jännitteen muutokseen.
-
Minkäänlaisia happo-emästitrauksia ei hyväksytä.
8. Majakin räjähdys 15 p.
8.1
Jätesäiliössä tapahtui kaksi pääasiallista reaktiota: natriumnitraatin hajoamisreaktio ja natriumasetaatin palamisreaktio. Natriumnitraatin hajoamisreaktiossa muodostui typpeä, happea ja natriumoksidia. Palamisreaktio oli täydellinen, ja siinä muodostui vain natriumasetaatin muodostamien alkuaineiden oksideja.
Kirjoita hajoamisreaktion ja palamisreaktion reaktioyhtälöt. Kirjoita myös niistä muodostettu kokonaisreaktioyhtälö, kun tiedetään, että kaikki natriumnitraatin hajoamisreaktiossa syntynyt happi kuluu natriumasetaatin palamisreaktiossa.
9 p.
Palamisreaktio:
2CH₃COONa(s) + 4O₂(g) → 4CO₂(g) + 3H₂O(g) + Na₂O(s)
(3 p.)
-
Oikeat aineet 1 p., oikeat kertoimet 1 p. ja oikeat olomuodot 1 p.
-
Jos reaktioyhtälössä on vääriä aineita, 0 p. koko reaktioyhtälöstä.
Hajoamisreaktio:
4NaNO₃(s) → 2Na₂O(s) + 2N₂(g) + 5O₂(g)
(3 p.)
-
Oikeat aineet 1 p., oikeat kertoimet 1 p. ja oikeat olomuodot 1 p.
-
Jos reaktioyhtälössä on vääriä aineita, 0 p. koko reaktioyhtälöstä.
Kokonaisreaktio:
16NaNO₃(s) + 10CH₃COONa(s) → 20CO₂ (g) + 13Na₂O (s) + 15H₂O (g) + 8N₂(g)
(3 p.)
-
Oikeat aineet 1 p. ja oikeat kertoimet 2 p.
-
Jos reaktioyhtälössä on vääriä aineita, 0 p. koko reaktioyhtälöstä.
-
Pisteitä kokonaisreaktion kertoimista ei voi ansaita, jos palamis- tai hajoamisreaktiossa on väärät kertoimet.
8.2
Ennen räjähdystä kaikki vesi oli haihtunut säiliöstä. Tällöin jäljelle jääneessä kiinteässä seoksessa oli 22,2 massaprosenttia natriumasetaattia ja 75,8 massaprosenttia natriumnitraatin ja kaliumdikromaatin seosta. Oletetaan, että kaliumdikromaatin osuus seoksessa oli niin pieni, että sitä ei tarvitse huomioida laskussa.
Perustele laskemalla, kumpi lähtöaineista oli reaktiossa rajoittava tekijä.
6 p.
M(NaNO₃) = (22,99 + 14,01 + 3 · 16,00) g/mol = 85,00 g/mol
M(NaCH₃COO) = (22,99 + 2 · 12,01 + 2 · 16,00 + 3 · 1,008) g/mol = 82,034 g/mol
(1 p.)
Merkitään koko seoksen massaa x:llä.
m(NaNO₃) = 0,758 · x
m(NaCH₃COO) = 0,222 · x
(1 p.)
n(NaNO₃) = m(NaNO₃) /M(NaNO₃)
= 0,758 · x / 85,00 g/mol
= 8,917647 mmol/g · x
n(NaCH₃COO) = m(NaCH₃COO) / M(NaCH₃COO)
= 0,222 · x / 82,034 g/mol
= 2,706195 mmol/g · x
(1 p.)
Stoikiometristen kertoimien perusteella
n(NaNO₃) / n(NaCH₃COO) = 16/10 = 8/5
n(NaNO₃) = 8/5 · n(NaCH₃COO).
(1 p.)
-
Jos laskussa käytetään virheellisiä kertoimia, 0 p. ja pisteiden kertyminen päättyy.
Lasketaan, onko natriumasetaattia käytettävissä tarpeeksi iso määrä stoikiometrisessä suhteessa natriumnitraattiin nähden:
8/5 · n(NaCH₃COO) = 8/5 · 2,706195 mmol/g · x = 4,329912 mmol/g · x
Tuloksesta nähdään, että natriumnitraattia on saatavilla ylimäärin verrattuna natriumasetaatin määrään.
TAI
8,917647 mmol/g · x / (2,706195 mmol/g · x) = 3,29527
Tuloksesta nähdään, että 3,29527 > 8/5, minkä takia natriumnitraattia on saatavilla ylimäärin verrattuna natriumasetaatin määrään.
(1 p.)
Natriumasetaatti on siis rajoittava tekijä.
(1 p.)
Vaihtoehtoinen ratkaisutapa
Oletetaan, että seosta on 100 g.
Tällöin
m(NaNO₃) = 75,8 g ja m(CH₃COONa) = 22,2 g,
joten
n(NaNO₃) = 0,8917646 mol ja n(CH₃COONa) = 0,2706195 mol.
(3 p.)
Stoikiometristen kertoimien perusteella
n(NaNO₃) / n(NaCH₃COO) = 16/10 = 8/5
n(NaNO₃) = 8/5 · n(NaCH₃COO).
(1 p.)
-
Jos laskussa käytetään virheellisiä kertoimia, 0 p. ja pisteiden kertyminen päättyy.
Rajoittavan tekijän päättely:
Lasketaan, onko natriumasetaattia käytettävissä tarpeeksi iso määrä stoikiometrisessä suhteessa natriumnitraattiin nähden:
8/5 · n(NaCH₃COO) = 8/5 · 0,2706195 mol = 0,4329912 mol
Tuloksesta nähdään, että natriumnitraattia on saatavilla ylimäärin verrattuna natriumasetaatin määrään. Natriumasetaatti on siis rajoittava tekijä.
TAI
0,891 764 7 mol / (0,2706195 mol) = 3,29527
Tuloksesta nähdään, että 3,29527 > 8/5.
Natriumnitraattia on siis saatavilla ylimäärin verrattuna natriumasetaatin määrään,
(1 p.)
joten natriumasetaatti on rajoittava tekijä.
(1 p.)
Osa 3: 20 pisteen tehtävät
9. Resorsyylihapon synteesi 20 p.
Aromaattiset substituutioreaktiot vaativat usein vahvoja, syövyttäviä reagensseja. Substituutioreaktiossa korvautuu aromaattisen renkaan vetyatomi, mutta molekyylin muu runko säilyy muuttumattomana. Resorsinolille voidaan kuitenkin tehdä substituutioreaktio hyvin miedoissa olosuhteissa lämmittämällä resorsinolin ja natriumvetykarbonaatin vesiliuosta. Natriumvetykarbonaattia on reaktioseoksessa ylimäärin.
Resorsyylihapon synteesissä on kaksi vaihetta oheisen kaavion mukaisesti. Vaiheessa 1 syntyy ensin natriumresorsylaattia. Vaiheessa 2 reaktioseosta jäähdytetään ja siihen lisätään suolahappoa (HCl:n vesiliuosta). Tällöin lopputuote eli resorsyylihappo kiteytyy seoksesta hienoina kiteinä. Resorsyylihappo on niukkaliukoinen kylmään veteen.
Tuotteen rakenteen varmistamiseksi hyödynnettiin 13C-NMR-spektroskopiaa. Tavallisessa 13C-NMR-spektrissä molekyylin jokaisesta erilaisessa kemiallisessa ympäristössä olevasta hiiliatomista tulee spektriin oma piikkinsä. Tuotteen 13C-NMR-spektrissä havaittiin piikit seuraavilla kemiallisilla siirtymillä: 172,3; 164,3; 163,7; 132,4; 108,5; 104,8 ja 102,7 ppm. Muita piikkejä ei havaittu. Lähtöaineena käytetyn resorsinolin 13C-NMR-spektrissä puolestaan havaittiin seuraavat seuraavat piikit: 160,1; 131,5; 107,7 ja 104,2 ppm.
Voit hyödyntää tiedostoja ja osatehtävien vastauksissa.
9.1 Vaiheiden 1 ja 2 reaktioyhtälöitä ei ole tasapainotettu ja kummastakin puuttuu reaktiotuote tai tuotteita. Esitä puuttuvien tuotteiden kemialliset kaavat ja nimet. 4 p.
Vaihe 1: vesi (1 p.) H₂O (1 p.).
Vaihe 2: natriumkloridi (1 p.) NaCl (1 p.).
-
Kaikissa kohdissa ylimääräinen väärä nimi tai kaava kumoaa oikean.
9.2
Reaktioseoksesta kiteytynyt resorsyylihappo erotetaan muista reaktioseoksen aineista, kuten jäljelle jääneistä lähtöaineista, liuottimesta ja suoloista. Tuotteena saadaan lopuksi puhdasta, kuivaa resorsyylihappoa.
Kuvaile laboratoriossa käytettävä menetelmä ja tarvittavat välineet, joilla reaktiossa muodostunut resorsyylihappo erotetaan siten, että tuote on puhdasta ja kuivaa.
5 p.
Tuotteena saatu resorsyylihappo suodatetaan erilleen suodatuksella/imusuodatuksella
(2 p.)
-
Myös sentrifugointi hyväksytään.
-
Muut menetelmät kuten dekantointi, 0 p. koko osatehtävästä. Jos kuvattu oikea ja väärä menetelmä, 0 p. koko osatehtävästä.
käyttämällä suodatussuppiloa tai (Büchner)-suppiloa ja suodatinpaperia.
(1 p.)
Tuotetta pestään (huuhdellaan) kylmällä vedellä
(1 p.)
-
Pesu täytyy tehdä nimenomaan vedellä.
ja tuotteen annetaan kuivua (esimerkiksi suodatinpaperin päällä) ilmassa tai lämpökaapissa.
(1 p.)
-
Mikäli kuivaus on tehty kuumentamalla esimerkiksi kaasupolttimella, 0 p.
9.3 Perustele resorsinolimolekyylin rakenteen avulla, miksi resorsinolin 13C-NMR-spektrissä on vain neljä piikkiä, vaikka resorsinolimolekyylissä on kuusi hiiliatomia. Käytä vastauksessa apunasi tehtävänannon kuvaan merkittyä resorsinolin hiilten numerointia. 3 p.
Resorsinolissa hiiliatomit 1 ja 3 ovat samanlaisessa kemiallisessa ympäristössä,
(1 p.)
samoin hiiliatomit 4 ja 6.
(1 p.)
-
Kemiallisten ympäristöjen lukumäärän voi päätellä myös ennustamalla spektrit MarvinSketch -ohjelmistolla.
Neljästä eri kemiallisesta ympäristöstä seuraa spektriin neljä piikkiä.
TAI
Samassa kemiallisessa ympäristössä olevat hiiliatomit tuottavat yhden piikin.
TAI
Loput kaksi hiiliatomia tuottavat kumpikin yhden piikin.
(1 p.)
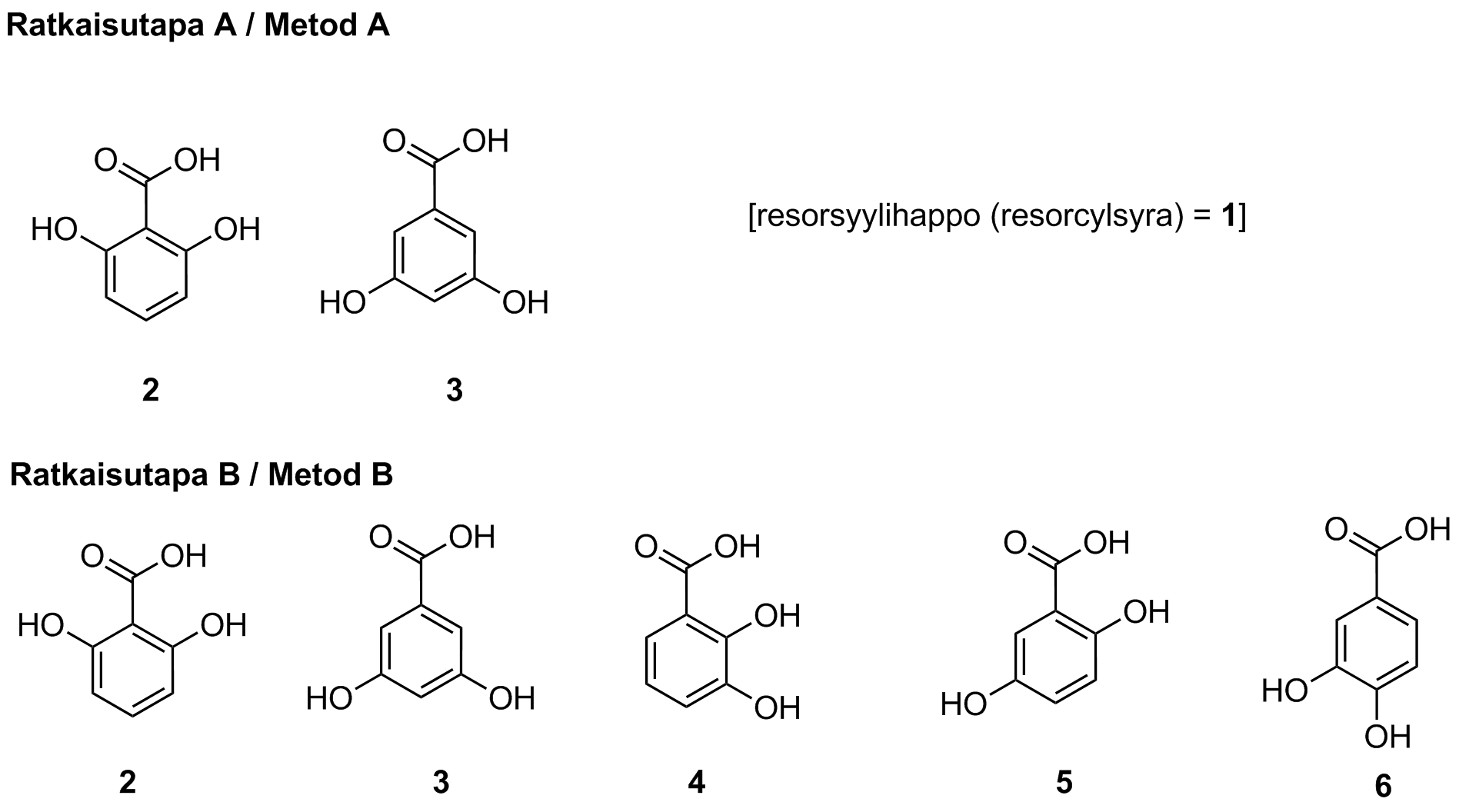
9.4 Resorsyylihapon synteesissä voi muodostua myös tuotteen paikkaisomeerejä. Esitä kaikkien resorsyylihapon paikkaisomeerien rakenteet. Perustele lisäksi tuotteen 13C-NMR-spektrin avulla, ettei reaktiossa saatu tuote voi olla mikään resorsyylihapon paikkaisomeereistä. 8 p.
Tehtävän voi ratkaista kahdella eri tavalla. Tavassa A tarkastellaan vain niitä paikkaisomeerejä, jotka voivat muodostua reaktiossa (2 ja 3). Tavassa B tarkastellaan kaikkia mahdollisia paikkaisomeerejä. Mikäli ratkaisussa esiintyy yksikin isomeereistä 4–6, vastaus pisteytetään ratkaisutavan B mukaan, muussa tapauksessa käytetään ratkaisutapaa A.
Ratkaisutapa A:
Piirretty rakenteet 2 ja 3.
(4 p.)
-
Jos vain toinen oikein, 2 p. ja pistekertymä päättyy. Tällöin selitysosuudesta ei voi ansaita pisteitä.
-
Jokainen virheellinen rakenne, ylimääräinen rakenne tai sama isomeeri useampaan kertaan kumoaa oikean isomeerin ansion.
-
Reaktiotuotteen rakenne 1 yhden tai useamman kerran, ei vähennystä.
Molemmissa paikkaisomeereissä hiiliatomit ovat viidessä eri kemiallisessa ympäristössä,
(1 p.)
joten niiden ¹³C-NMR-spektrissä on kummassakin vain viisi piikkiä.
(1 p.)
-
Pisteen voi ansaita myös ennustamalla molempien isomeerien ¹³C-NMR-spektrit MarvinSketch -ohjelmistolla ja toteamalla, että kummankin isomeerin spektrissä piikkejä on viisi.
Tuotteen ¹³C-NMR-spektrissä on kuitenkin seitsemän piikkiä, joten tuote ei voi olla kumpikaan esitetyistä paikkaisomeereistä.
(2 p.)
-
Viimeiset 2 p. voi ansaita vain mikäli on ansainnut ainakin toisen kahdesta edeltävästä pisteestä.
-
Pisteet voi ansaita myös ennustamalla rakenteiden 1–3 ¹³C-NMR-spektrit MarvinSketch -ohjelmistolla, ja toteamalla, että isomeerien 2 ja 3 ¹³C-NMR-spektreissä piikit ovat eri paikoissa kuin reaktiotuotteen 1 ¹³C-NMR-spektrissä.
Ratkaisutapa B:
Piirretty rakenteet 2–6.
(4 p.)
-
Kaikki viisi isomeeriä on oltava oikein, jotta pistekertymä jatkuisi selitysosuuteen. Jos yksi tai useampi puuttuu tai on väärin tai on esitetty useampaan kertaan, pistekertymä päättyy rakennekaavojen jälkeen.
-
Neljä oikeaa isomeeriä 3 p., kolme oikeaa isomeeriä 2 p., kaksi oikeaa isomeeriä 1 p.
-
Jokainen virheellinen rakenne, ylimääräinen rakenne tai sama isomeeri useampaan kertaan kumoaa oikean isomeerin.
-
Reaktiotuotteen rakenne 1 yhden tai useamman kerran, ei vähennystä.
Isomeereissä 2 ja 3 C-atomit ovat viidessä eri kemiallisessa ympäristössä
(1 p.)
ja siten niiden ¹³C-NMR-spektrissä on kummassakin vain viisi piikkiä/kemiallista siirtymää.
(1 p.)
-
Pisteen voi ansaita myös ennustamalla isomeerien ¹³C-NMR-spektrit MarvinSketch -ohjelmistolla.
Isomeerien 4–6 ¹³C-NMR-spektrit on ennustettu MarvinSketch -ohjelmistolla.
(1 p.)
Tuotteen 1 ¹³C-NMR-spektri ei vastaa mitään näistä ennustetuista spektreistä.
(1 p.)
-
Pisteen voi ansaita vain, jos on ansainnut vähintään toisen isomeerien 2 ja 3 ¹³C-NMR-spektriin liittyvistä pisteistä sekä isomeerien 4–6 ¹³C-NMR-spektreihin liittyvän pisteen.
10. Höyrynpaine ja höyrystymisentalpia 20 p.
10.1 Veden höyrystymisentalpia on 40,66 kJ/mol. Perustele kemiallisesti, miksi veden höyrystymisentalpia on suurempi kuin asetonin. 4 p.
Vesi muodostaa vetysidoksia toisiin vesimolekyyleihin.
(1 p.)
Asetoni muodostaa dipoli-dipoli-sidoksia toisiin asetonimolekyyleihin.
(1 p.)
Vetysidokset ovat voimakkaampia kuin dipoli-dipolisidokset.
(1 p.)
-
Pisteen voi ansaita vain jos aiemmat pisteet on ansaittu.
Tästä syystä vesimolekyylien väliset sidokset ovat voimakkaampia ja höyrystäminen vaatii enemmän energiaa.
(1 p.)
-
Pisteen voi ansaita vain jos aiemmat pisteet on ansaittu. Piste edellyttää myös, että vetysidokset ja dipoli-dipolisidokset on kohdistettu molekyylien välille.
10.2 Laadi taulukon arvojen perusteella kuvaaja ja määritä tämän kuvaajan avulla asetonin höyrystymisentalpia. 8 p.
Kuvakaappaus esimerkkikuvaajasta, joka on laadittu Geogebralla.
Piirretty kuvaaja:
-
1/T -arvot on laskettu oikein (1 p.)
-
Jos vaaka-akselilla on lämpötilan T arvot (1/T):n arvojen tilalla, 0 p. koko osatehtävästä.
-
-
Akselit ovat oikein päin ja molemmille akseleille on merkitty suureet oikein (1 p.)
-
Mittapisteisiin on sovitettu suora (1 p.)
Sovitetun suoran yhtälö:
y = −3850,651 · x + 16,341
(1 p.)
-
Pelkkä kulmakertoimen tarkastelu riittää.
-
Kulmakertoimen numeerisen arvon pitää olla välillä –3852 – –3837.
\mathrm{Kulmakerroin}=-\frac{\Delta H_{\mathrm{vap}}}{R}=-3\ 850{,}651\ \mathrm{K}
(1 p.)
\Delta H_{\mathrm{vap}}=R\cdot3\ 850{,}651\ \mathrm{K}=8{,}314463\frac{\mathrm{J}}{\mathrm{K\cdot mol}}\cdot3\ 850{,}651\ \mathrm{K}=32{,}0161\ \mathrm{kJ/mol}\approx32{,}02\mathrm{kJ/mol}
(3 p.)
10.3 Aineistossa esitettyä Clausiuksen–Clapeyronin yhtälöä johdettaessa on oletettu, että höyrystymisentalpian arvo ei riipu lämpötilasta. Todellisuudessa höyrystymisentalpian arvo yleensä pienenee hieman lämpötilan kasvaessa. Perustele, miksi aine höyrystyy helpommin, kun lämpötila kasvaa. 4 p.
Lämpötilan kasvattaminen katkaisee osan nestemolekyylien välisistä sidoksista
TAI
Nestemolekyylien kineettinen energia kasvaa
(2 p.)
ja täten höyrystyminen vaatii vähemmän (lisä)energiaa
TAI
ja täten molekyylit siirtyvät kaasufaasiin helpommin.
(2 p.)
10.4 Jos asetonia vahingossa päätyy iholle, iho tuntuu viileältä. Tämä liittyy asetonin alhaiseen kiehumispisteeseen (56 °C) ja asetonin tehokkaaseen höyrystymiseen ihon pinnalta. Perustele, mistä asetonin aiheuttama ihon viileneminen johtuu. 4 p.
Höyrystyminen on endoterminen prosessi eli se sitoo lämpöenergiaa
(2 p.)
ympäristöstä/ihosta, ja asetonin höyrystyminen laskee ihon lämpötilaa.
(2 p.)
11. Empiirisen kaavan määritys 20 p.
Tuntemattoman yhdisteen empiirinen kaava (CxHyNz) määritettiin kahden kokeen avulla.
Koe 1 perustui hajoamisreaktioon, jossa kyseistä tuntematonta yhdistettä (CxHyNz) hajotettiin 0,1500 g. Reaktiossa syntyi 16,4 ml typpikaasua (t = 27,0 °C ja p = 97 300 Pa). Tässä kokeessa kaikki yhdisteessä oleva typpi muuttui typpikaasuksi.
Kokeen 2 koeasetelma on esitetty oheisessa kuvassa.
Kokeessa 2 samasta yhdisteestä otettiin näyte, jonka massa oli 0,2000 g, ja näyte poltettiin. Kokeen 2 täydellisen palamisreaktion tuotteet johdettiin kahden putken läpi. Näistä ensimmäinen oli täytetty kalsiumkloridilla ja toinen kaliumhydroksidilla. Kalsiumkloridilla täytetyn putken massa kasvoi 0,1078 g. Kaliumhydroksidilla täytetyn putken massa kasvoi 0,6026 g.
11.1
Mihin perustui kalsiumkloridilla ja kaliumhydroksidilla täytettyjen putkien massojen kasvu? Hyödynnä seuraavia reaktioyhtälöitä:
CaCl₂(s) + 2H₂O(g/l) → CaCl₂·2H₂O(s)
2KOH(s) + CO₂(g) → K₂CO₃(s) + H₂O(l)
Molempien reaktioiden tuotteet jäivät putkiin.
5 p.
2KOH(s) + CO₂(g) → K₂CO₃(s) + H₂O(l)
Näytteen poltossa syntyvä vesi sitoutuu kalsiumkloridiin
(1 p.)
kidevedeksi, jolloin kalsiumkloridiputken massa kasvaa.
(1 p.)
Polttoreaktiossa syntyvä hiilidioksidi reagoi kaliumhydroksidin kanssa,
(2 p.)
jolloin syntyy kaliumkarbonaattia ja vettä. Tällöin kaliumhydroksidilla täytetyn putken massa kasvaa.
(1 p.)
-
Vastauksessa edellytetään, että reaktiot on kohdistettu oikeisiin aineisiin.
11.2 Määritä kokeiden perusteella tuntemattoman yhdisteen (CxHyNz) empiirinen kaava. 15 p.
Koe 1 (hajoamisreaktio):
n(N₂) = pV / RT = (97300 Pa · 0,0000164 m³) / (8,31446 Pa · m³/(K · mol) · 300,15 K) = 0,00063942 mol
(2 p.)
Koe 2 (polttoanalyysi):
Kalsiumkloridilla täytetyn putken massa kasvoi 0,1078 g. Tämä vastaa veden massaa.
n(H₂O) = m(H₂O) / M(H₂O) = 0,1078 g / 18,016 g/mol = 0,0059836 mol
(2 p.)
Kaliumhydroksidilla täytetyn putken massa kasvoi 0,6026 g. Tämä vastaa hiilidioksidin massaa.
n(CO₂) = m(CO₂) / M(CO₂) = 0,6026 g / 44,01 g/mol = 0,013692 mol
(2 p.)
Tulosten yhdistäminen:
Hajoamisreaktiossa (koe 1) tuntematonta yhdistettä käytettiin 0,1500 g, kun taas polttoanalyysissä (koe 2) yhdistettä oli 0,2000 g. Jos hajoamisreaktiossa olisi käytetty sama massa kuin polttoreaktiossa, typpeä olisi syntynyt
n(N₂) = 0,00063941 mol · (0,2000 g / 0,1500 g) = 0,00085256 mol.
(2 p.)
n(N₂) = 0,00085256 mol
n(CO₂) = 0,013692 mol
n(H₂O) = 0,0059836 mol
Muutetaan nämä alkuaineatomien ainemääriksi:
n(N) = 2 · n(N₂) = 2 · 0,00085256 mol = 0,0017051 mol
- Jos hajoamisreaktiota ei ole hyödynnetty vastauksessa ollenkaan vaan typen ainemäärä on laskettu polttokokeen kautta, tätä edeltäviä typen määrittämiseen liittyviä pisteitä ei ansaita, mutta lopun laskun pisteet voi edelleen ansaita.
n(C) = n(CO₂) = 0,013692 mol
n(H) = 2 · n(H₂O) = 2 · 0,0059836 mol = 0,01196714 mol
(4 p.)
-
Jos kaikki kolme ainemäärää oikein 4 p., jos kaksi oikein, 2 p. ja jos yksi oikein, 1 p.
Jaetaan luvut pienimmällä ainemäärällä (n(N) = 0,0017051 mol):
N: 1
C: 0,013692 mol / (0,0017051 mol) = 8,03
(1 p.)
H: 0,011967 mol / (0,0017051 mol) = 7,02
(1 p.)
Empiirinen kaava on C₈H₇N (tai (C₈H₇N)ₓ).
(1 p.)
-
Jos empiiristä kaavaa kutsuu molekyylikaavaksi, viimeinen piste menetetään.
(Kyseessä voisi olla esimerkiksi indoli.)