Beskrivningar av goda svar: SV – Kemi
18.9.2024
Slutgiltiga beskrivningar av goda svar 14.11.2024
Grunderna enligt vilka bedömningen gjorts framkommer i de slutgiltiga beskrivningarna av goda svar. Uppgiften om hur bedömningsgrunderna tillämpats på examinandens provprestation utgörs av de poäng som examinanden fått för sin provprestation, de slutgiltiga beskrivningarna av goda svar och de föreskrifter gällande bedömningen som nämnden gett i sina föreskrifter och anvisningar. De slutgiltiga beskrivningarna av goda svar innehåller och beskriver inte nödvändigtvis alla godkända svarsalternativ eller alla godkända detaljer i ett godkänt svar. Eventuella bedömningsmarkeringar i provprestationerna anses vara jämställbara med anteckningar och sålunda ger de, eller avsaknaden av markeringar, inte direkta uppgifter om hur bedömningsgrunderna tillämpats på provprestationen.
Med studentexamensprovet utreds om studerandena tillägnat sig de kunskaper och färdigheter som anges i gymnasiets läroplan och uppnått tillräcklig mognad enligt målen för gymnasieutbildningen. Målet för bedömningen i läroämnet kemi är en förståelse för och en tillämpning av den kemiska kunskapen. Vid bedömningen beaktas även de färdigheter med vilka man tillägnar sig experimentell kunskap och förmågan att behandla den. Till sådan kunskap hör till exempel planering av experiment, trygg hantering av arbetsredskap och reagens, presentation och tolkning av resultat samt förmågan att dra slutsatser och tillämpa dem.
Vid bedömningen av uppgifterna i kemi läggs vikten vid ett framställningssätt som betonar läroämnets karaktär och vid precision i begreppen och språkbruket. Reaktionsformlerna ställs upp utan oxidationstal med minsta möjliga heltalskoefficienter och med aggregationstillstånden angivna. I organiska reaktionslikheter används strukturformler, men aggregationstillstånd krävs inte. Olika sätt att skriva strukturformler godkänns.
I beräkningsuppgifter ska storhetsekvationer och formler användas på ett sätt som visar att examinanden förstått uppgiften rätt och tillämpat korrekt princip eller lag i sin lösning. Av svaret framgår entydigt hur man når slutresultatet, men omfattande mellansteg behövs inte. CAS-program kan utnyttjas i uppgiftens olika skeden. De principer och lagar som gäller den aktuella situationen samt uppgiftens slutresultat och de slutsatser som dras utgående från lösningen är av central betydelse och ska framgå av svaret. Slutresultaten ges med enheter och med den noggrannhet som utgångsvärdena kräver, och slutsatserna motiveras.
Mätresultat och grafer som ritats utgående från dessa utnyttjas vid analysen av data och då man drar slutsatser. Till mätpunkterna anpassas en vederbörlig rät linje Värden som ligger mellan mätpunkterna kan interpoleras med ögonmått genom visuell avläsning av grafen eller med hjälp av ett lämpligt program. Axlarnas namn, enheter och skala märks ut i grafen. I grafen anges sådana punkter som är väsentliga för slutsatserna, som ekvivalenspunkten för en titrerkurva eller tangenten som används när man beräknar en hastighet vid en given tidpunkt.
I essäsvar och förklarande svar kompletteras texten med reaktionsformler, ekvationer eller teckningar. Fenomenen som behandlas beskrivs på makroskopisk, mikroskopisk och symbolisk nivå. Av svaret framgår att det material som hör ihop med uppgiften har använts, tillämpats, analyserats och utvärderats i enlighet med uppgiftsformuleringen. Ett svar på god nivå är välstrukturerat och innehållsmässigt konsekvent.
Svaren bedöms enligt de kriterier som gäller för respektive uppgift. Utgångspunkten vid bedömningen är de förtjänster för vilka poäng ansamlas. Om en central kemisk princip saknas eller är felaktig avslutas poängansamlingen. Då godkänns inte fortplantning av det felaktiga resultatet (ej-FF). Exempel på sådana fel är stökiometrifel, fel begränsande faktor samt fel ämne i en reaktionslikhet. För övriga brister eller fel godkänns fortplantning av det felaktiga resultatet (FF), och då fortsätter ansamlingen av poäng efter bristfälligheten eller felet. I de krävande uppgifterna i provets del 3 förutsätts en större precision i behandlingen av principer än i de grundläggande uppgifterna i början av provet. Ur kemisk synvinkel inexakt språkbruk, små räknefel eller slarvig användning av närmevärden orsakar avdrag på 0–3 p. till exempel på följande sätt:
- avrundnings- och kopieringsfel som inte påverkar slutresultatet, −0 p.
- kopieringsfel, avrundningsfel och små slarvfel som påverkar slutresultatet, ett enskilt litet fel i en strukturformel, −1 p.
- enhetsomvandlingsfel, systematiska fel i en strukturformel samt övriga fel som till sin natur är allvarligare än små fel, men där det ändå inte är fråga om en felaktig kemisk princip, −2 p.
Del 1: 20-poängsuppgift
1. Flervalsuppgifter från kemins olika delområden 20 p.
1.1 På bordet i ett laboratorium finns en flaska som innehåller en vattenlösning av NaOH. Du vill bestämma lösningens koncentration. Vilken av följande tekniker är lämplig för det här ändamålet? 2 p.
- titrering (2 p.)
1.2 Vilket av följande grundämnespar kan bilda en kovalent bindning? 2 p.
- väte och kol (2 p.)
1.3 Det totala lufttrycket i ett bildäck är 3,00 bar då luftens temperatur är 10 °C. Följande dag är temperaturen 20 °C. Hur stort är då däckstrycket? Anta att volymen för däcket inte förändras. 2 p.
- 2,90 bar (2 p.)
- 3,11 bar (2 p.)
1.4
Utgångsämnena A och B som är i gasform har förts in i en reaktor. De reagerar till produkt C enligt följande reaktionsformel:
A(g) + B(g) → C(g).
Vilken av följande åtgärder leder INTE till att hastigheten för bildandet av produkten ökar?
2 p.
- En höjning av reaktorns tryck genom att man leder in en inert gas som till exempel argon i reaktorn. (2 p.)
1.5 I grafen visas hur koncentrationerna för utgångsämnet, mellanprodukten och slutprodukten i en kemisk reaktion förändras som funktion av tiden. Vilket av följande påståenden stämmer? 2 p.
- A är mellanprodukt, B är slutprodukt och C är utgångsämne. (2 p.)
1.6 I vilken av följande föreningar förekommer en jonbindning? 2 p.
- NH₄Cl (2 p.)
1.7
En galvanisk cell har följande cellschema:
−Fe(s) | Fe²⁺(aq) || Au⁺(aq) | Au(s) +.
Vilken är cellspänningen för den här cellen?
2 p.
−Fe(s) | Fe²⁺(aq) || Au⁺(aq) | Au(s) +.
- 2,14 V (2 p.)
1.8 Heliumgas upphettas i en ballong så att trycket inte förändras. Då 2 p.
- ökar heliumets volym. (2 p.)
1.9 Vilket av följande ämnen är en halvmetall som används inom elektronikindustrin? 2 p.
- kisel (2 p.)
1.10 En forskare vill bestämma hurdana bindningar en okänd organisk förening har. Hen är intresserad av hur atomerna binds till varandra och hur kolvätestammen är förgrenad. Vilken av följande forskningsmetoder lönar det sig för forskaren att använda för att få de bästa svaren på hens forskningsfrågor? 2 p.
- NMR-spektroskopi (2 p.)
Del 2: 15-poängsuppgifter
2. Periodiska systemet och grundämnens egenskaper 15 p.
Komplettera följande meningar med de ord eller talvärden som saknas. Du ska skriva högst två ord eller talvärden i varje lucka.
Grundämnenas periodiska system samt grundämnenas namn och symboler hittas i provmiljöns instruktioner.
2.1 Grundläggande termer gällande grundämnenas periodiska system 4 p.
2.1.1 1 p.
- atomnummer (1 p.)
- ordningstal (1 p.)
- protontal (1 p.)
2.1.2 1 p.
- atommassan (1 p.)
2.1.3 1 p.
- perioder (1 p.)
2.1.4 1 p.
- grupper (1 p.)
2.2 Grundämnens egenskaper 5 p.
2.2.1 1 p.
- alkalimetaller (1 p.)
2.2.2 1 p.
- radioaktiva (1 p.)
- instabila (1 p.)
2.2.3 1 p.
- kolmonoxid (1 p.)
2.2.4 1 p.
- sur (1 p.)
2.2.5 1 p.
- +2 (1 p.)
2.3 Periodiska egenskaper 6 p.
2.3.1 1 p.
- elektronegativitet (1 p.)
- effektiv kärnladdning (1 p.)
2.3.2 1 p.
- högra (1 p.)
2.3.3 1 p.
- jonisationsenergin (1 p.)
2.3.4 1 p.
- mindre (1 p.)
2.3.5 1 p.
- större (1 p.)
2.3.6 1 p.
- mindre (1 p.)
Även andra korrekta uttryck godkänns. Små skrivfel leder inte till poängavdrag.
3. Fenomen i vardagen 15 p.
3.1 Varför bildas det bubblor i en läskedrycksflaska som förvarats i kylskåpet när man öppnar den, som i bilden invid? Skriv också reaktionsformeln (reaktionslikheten) som beskriver fenomenet. 5 p.
Läskedrycksflaskor innehåller kolsyra/koldioxid.
(1 p.)
-
Både rätt ämne och fel ämne, 0 p.
Då läskedrycksflaskan öppnas minskar trycket inne i flaskan / bildas ett öppet system, som inte längre är i jämvikt och koldioxidens löslighet minskar / förflyttas jämvikten mot koldioxid i gasform.
(1 p.)
Då frigörs koldioxiden/kolsyran som finns i drycken som koldioxidgas. Det observeras som bubblor.
(1 p.)
-
Både rätt gas och fel gas, 0 p.
H₂CO₃(aq) → H₂O(l) + CO₂(g)
ELLER
CO₂(aq) → CO₂(g)
(2 p.)
- Rätt ämnen och koefficienter 1 p., rätt aggregationstillstånd 1 p. Poängen för aggregationstillstånden kan ansamlas bara om ämnena och koefficienterna är rätt.
3.2 Varför kan man avlägsna en fettfläck med hjälp av tvål? Motivera ditt svar med hjälp av den kemiska strukturen för tvål. I ditt svar kan du utnyttja strukturformeln för natriumpalmitat som visas i bilden invid. 5 p.
(Tvål består av fettsyrors natrium- eller kaliumsalter.) Tvålens natrium- och kaliumsalter innehåller en fettlöslig/opolär kolvätekedja
(1 p.)
och en vattenlöslig/polär karboxyldel.
(1 p.)
-
Den opolära och den polära delen måste specificeras rätt för att poängen ska ansamlas.
Den fettlösliga/opolära delen av tvålen binder till fettfläcken med dispersionskrafter.
(1 p.)
Tvålens vattenlösliga / polära ända bildar vätebindningar med vatten.
(1 p.)
Då det finns många tvålmolekyler kommer deras polära ända / karboxyldel att bilda en micell / en bollformad struktur vars yttre yta utgörs av de polära ändarna.
ELLER
Sköljvattnet kan skölja bort fettfläcken.
(1 p.)
-
Den sista poängen kan erhållas enbart om någon av de föregående poängen i deluppgiften erhållits.
3.3 Fetter består av fettsyrors estrar. Mättade fetter är ofta fasta vid rumstemperatur och omättade fetter är vätskeformiga. Förklara vad den här skillnaden beror på. I ditt svar kan du utnyttja bilden invid som visar strukturformlerna för en mättad fettsyra (stearinsyra) och en omättad fettsyra (oleinsyra alltså oljesyra). 5 p.
I omättade fetter / oleinsyran finns det dubbelbindningar mellan kolatomer.
ELLER
I mättade fetter / stearinsyran finns inte dubbelbindningar mellan kolatomer.
(1 p.)
-
Om svaret utgår från en trippelbindning eller C=O-dubbelbindningen avslutas poängansamlingen.
-
Om svaret utgår från både dubbelbindning och trippelbindning kan högst 3 p. ansamlas för strukturbeskrivningen, men sedan avslutas poängansamlingen, så de två sista poängen i deluppgiften kan inte erhållas.
Därför är kolvätekedjorna i omättade fetter böjda. Då kan omättade fetters molekyler inte komma nära varandra.
ELLER
Då är kolvätekedjorna i mättade fetters molekyler raka. Då kan mättade fetters molekyler komma nära varandra.
(1 p.)
Ett omättat vätskeformat fett / oleinsyran är till sin struktur en cis/Z-isomer.
(1 p.)
Det bildas mera dispersionskrafter mellan raka kolvätekedjor än mellan böjda kolvätekedjor.
(1 p.)
Därför är smältpunkterna högre för mättade fetter än för omättade fetter.
ELLER
Det krävs mer energi för att bryta dispersionskrafterna mellan mättade fetters molekyler.
(1 p.)
-
Den sista poängen kan erhållas bara om den föregående poängen erhållits (jämförelsen av dispersionkrafterna).
4. Föreningar med anknytning till Parkinsons sjukdom 15 p.
4.1 Namnge de funktionella grupperna i rotigotin som innehåller en kväveatom eller en syreatom. 2 p.
Den funktionella gruppen som innehåller en kväveatom är en tertiär aminogrupp.
(1 p.)
-
"Amingrupp", 0 p.
Syreatomen ingår i en fenolisk hydroxigrupp / fenolisk hydroxylgrupp.
(1 p.)
-
Om svaret innehåller fler än två funktionella grupper upphäver varje överlopps grupp poängen för en korrekt grupp. Omnämnande av hydroxigrupp eller bensenring ger ändå inget avdrag.
4.2 Förekommer konformationsisomeri eller enantiomeri (spegelbildsisomeri/optisk isomeri) för rotigotin? Motivera ditt svar. Du kan utnyttja filen i ditt svar. 5 p.
Det förekommer konformationsisomeri hos rotigotin
(1 p.)
eftersom den innehåller enkla C–C / C–N / C–O-bindningar som kan vridas.
(1 p.)
-
Enkelbindningen måste vara angiven mellan rätt grundämnesatomer för att poäng ska ansamlas.
-
För att poäng ska ansamlas måste rätt isomerislag identifieras.
Det förekommer enantiomeri hos rotigotin
(1 p.)
eftersom den innehåller en asymmetrisk kolatom
(1 p.)
som är markerad i strukturen med en stjärna. (Den rätta kolatomen kan också identifieras med hjälp av en beskrivning med ord).
(1 p.)
-
De två sista poängen kan ansamlas enbart om rätt isomerislag har identifierats.
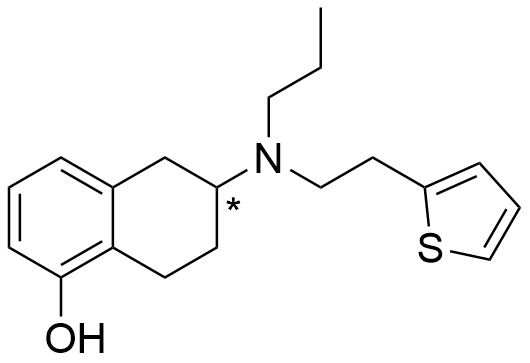 Strukturen för rotigotin med den asymmetriska kolatomen markerad.
Strukturen för rotigotin med den asymmetriska kolatomen markerad.
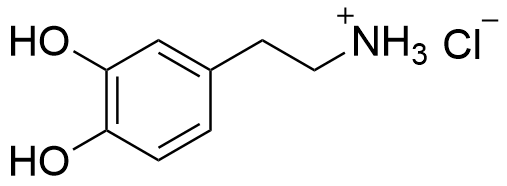
4.3 Rita strukturformeln för det salt som bildas då dopamin reagerar med väteklorid (HCl). Du kan utnyttja filen i ditt svar. 4 p.
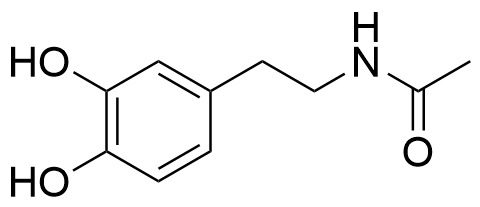
4.4 I ett läkemedelsutvecklingsprojekt undersöktes de biologiska effekterna av amidderivat av dopamin. Föreningarna framställdes genom kondensationsreaktioner mellan dopamin och olika karboxylsyror. Rita strukturformeln för den förening som bildas då dopamin reagerar med ättiksyra (etansyra) så att en amid bildas. Du kan utnyttja filen i ditt svar. 4 p.
5. Restaurering av ett örlogsfartyg 15 p.
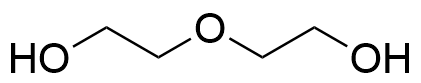
5.1 Rita strukturen för PEG-molekylen som två upprepande enheter (n = 2). Vilken funktionell grupp finns i mitten av strukturen? 4 p.
5.2 I material visas strukturformeln för cellulosa. Med vilka bindningar binds PEG-molekylerna till cellulosamolekylerna i skrovets material? Hur bildas de här bindningarna mellan PEG-molekylerna och cellulosamolekylerna? 6 p.
Poängen kan ansamlas på olika sätt. De totala poängen (högst 6 p.) kan ansamlas av följande förtjänster:
-
Hela deluppgiften ger 0 p. om det sägs eller visas i en teckning att övriga bindningar än vätebindningar, dipol-dipolbindningar eller dispersionskrafter bildas mellan PEG- och cellulosamolekylerna.
Det bildas vätebindningar mellan PEG- och cellulosamolekylerna.
(1 p.)
Vätebindningen är placerad mellan en syreatom och väteatomen i en OH-grupp.
(1 p.)
Det bildas en enskild vätebindning mellan etergruppens syreatom i PEG-molekylen och väteatomen i cellulosamolekylens –OH-grupp, mellan PEG-molekylens OH-grupp och syreatomen i cellulosans etergrupp/acetalgrupp, och mellan PEG-molekylens OH-grupp och cellulosans OH-grupp.
(4 p.)
-
En vätebindning är rätt placerad, 2 p., två är placerade rätt, 3 p. och alla tre är placerade rätt, 4 p.
Hydroxigrupperna i cellulosamolekylen har polära O–H-bindningar.
ELLER
Bindningens syreatom får en negativ delladdning och väteatomen får en positiv delladdning.
(1 p.)
Etersyret i PEG-molekylen har en negativ delladdning eftersom C–O-bindningen är polär / syreatomen i C–O-bindningen är mer elektronegativ än kolatomen.
ELLER
Etersyret i PEG-molekylerna har ett fritt elektronpar.
(1 p.)
Det bildas också dispersionsbindningar mellan PEG- och cellulosamolekylerna.
(1 p.)
Svaret innehåller en beskrivning av hur dispersionskrafterna bildas.
(1 p.)
5.3 I material visas strukturformlerna för cellulosa och en form av stärkelse (amylos). Jämför strukturerna för cellulosa och stärkelse och beskriv de viktiga skillnaderna. Motivera med hjälp av strukturerna varför cellulosa är en central fiberformad beståndsdel i trä. Varför bildar stärkelse inte fibrer? 5 p.
Stärkelse bildar en spiralformad struktur
(1 p.)
och cellulosa bildar en rak struktur.
(1 p.)
Skillnaden beror på hur glykosidbindningen är riktad: I stärkelse är glykosidbindningen riktad bortåt från den sexatomiga ringstrukturens plan medan glykosidbindningen i cellulosa är i ringens plan.
(1 p.)
-
Termen glykosidbindning behöver inte explicit nämnas men den rätta strukturen ska identifieras i svaret.
Det bildas vätebindningar / dipol-dipolbindningar mellan cellulosamolekylerna.
(1 p.)
Eftersom cellulosamolekylerna bildar en rak struktur kan molekylerna bindas nära varandra (med vätebindningar).
ELLER
Eftersom stärkelsens amylosmolekyler är spiralformade kan inte molekylerna bindas lika nära varandra som cellulosamolekylerna. Då bildas inte en fiberaktig struktur.
(1 p.)
6. Kvävets kretslopp i naturen 15 p.
6.1 Bestäm oxidationstalen (oxidationstillstånden) för kväve i följande molekyler eller joner: 5 p.
6.1.1 1 p.
- 0 (1 p.)
6.1.2 1 p.
- –3 (1 p.)
6.1.3 1 p.
- –3 (1 p.)
6.1.4 1 p.
- +3 (1 p.)
6.1.5 1 p.
- +5 (1 p.)
Oxidationstalen kan skrivas antingen med arabiska eller romerska siffror och även i ord. Små skrivfel ger inte poängavdrag.
6.2 Studera material och . I anammox-reaktionen reagerar nitritjonen med ammoniumjonen och det bildas kvävgas och vätskeformigt vatten. Skriv reaktionsformeln (reaktionslikheten) för anammox-reaktionen och beräkna reaktionsentalpin för reaktionen. Använd bildningsentalpivärdena i tabell . I uppgiften antas att jonerna är i vattenlösning. 7 p.
Reaktionen är
NO₂⁻(aq) + NH₄⁺(aq) → N₂(g) + 2H₂O(l).
(3 p.)
-
Rätt ämnen 1 p., rätt koefficienter 1 p., och rätt aggregationstillstånd 1 p.
-
Om något felaktigt ämne ingår i reaktionsformeln, 0 p. för hela deluppgiften.
-
Felaktiga koefficienter i reaktionsformeln leder till att poägen för koefficienterna och för beräkningen av reaktionsentalpin inte ansamlas.
Reaktionsentalpin ΔHr kan beräknas med hjälp av formeln
ΔHr = ∑(ΔHf(produkter)) − ∑(ΔHf(utgångsämnen)).
ΔHr = ΔHf(N₂(g)) + 2 · ΔHf(H₂O(l)) −[ΔHf(NO₂⁻(aq)) + ΔHf(NH₄⁺(aq))]
(1 p.)
= [0,0 + 2 · (−285,8)] kJ/mol − [−100,0 + (−133,1)] kJ/mol
(1 p.)
-
Fel i entalpivärdenas förtecken, 0 p. och ansamlingen av poäng avslutas.
= −338,5 kJ/mol
(2 p.)
6.3 Kvävebindande bakterier innehåller vanligen nitrogenasenzym. Nitrogenasenzymet möjliggör att kväve kan bindas ur luften. Varför krävs det enzymer för att binda kvävemolekyler som ammoniak eller som ammoniumjoner? 3 p.
Kvävemolekylen har en (stark) trippelbindning.
(1 p.)
Kvävemolekylen är en väldigt stabil molekyl / aktiveringsenergin för kvävebindningsprocessen är hög / det krävs mycket energi för att bryta kävemolekylens trippelbindning.
(1 p.)
Ett enzym är en katalysator som sänker aktiveringsenergin / gör reaktionen snabbare.
(1 p.)
7. Titrering av bensoesyra 15 p.
7.1
Volymen för en bensoesyralösning var 25,0 ml. Man titrerade lösningen med natriumhydroxidlösning som hade koncentrationen 0,050 mol/l. Vid titreringen förbrukades 11,3 ml natriumhydroxid. Under titreringen mättes pH-värdet med en pH-mätare. Bensoesyrans syrakonstant är Ka = 6,28 · 10⁻⁵ (mol/l). Strukturen för bensoesyra visas i bilden invid.
Beräkna lösningens pH vid titreringens ekvivalenspunkt med en decimals noggrannhet (t = 25 °C).
12 p.
Titreringsreaktionen:
C₆H₅COOH(aq) + NaOH(aq) → C₆H₅COO⁻(aq) + Na⁺(aq) + H₂O(l)
-
Reaktionsformeln krävs inte.
n(NaOH) = c(NaOH) · V(NaOH) = 0,050 mol/l · 0,0113 l = 0,000565 mol
(1 p.)
Utifrån koefficienterna i titreringsreaktionen kan vi dra slutsatsen att
n(C₆H₅COO⁻) = n(NaOH)
(2 p.)
c(C₆H₅COO⁻) = n(C₆H₅COO⁻) / V = 0,000565 mol / (0,0250 l + 0,0113 l) = 0,0155647 mol/l.
(1 p.)
-
Om totalvolymen inte är beaktad på rätt sätt i beräkningarna avslutas poängansamlingen. Poängen för beräkningen av baskonstatens värde och för baskostantens rätta uttryck kan ändå ansamlas.
I lösningen protolyseras bensoatjonen:
C₆H₅COO⁻(aq) + H₂O(l) ⇌ C₆H₅COOH(aq) + OH⁻(aq).
Betraktelse av jämvikten:
| C₆H₅COO⁻(aq) | + H₂O(l) | ⇌ | C₆H₅COOH(aq) | + OH⁻(aq) | |
|---|---|---|---|---|---|
| i början [mol/l] | 0,0155647 | – | 0 | 0 | |
| förändring [mol/l] | −x | – | +x | +x | |
| vid jämvikt [mol/l] | 0,0155647 − x | – | x | x |
(2 p.)
-
Om jämvikten har ställts upp felaktigt avslutas poängansamlingen.
Kb = Kw / Ka = (1,008 · 10⁻¹⁴ (mol/l)²) / (6,28 · 10⁻⁵ mol/l) = 1,6050955 · 10⁻¹⁰ mol/l
(1 p.)
Kb = [C₆H₅COOH] · [OH⁻] / [C₆H₅COO⁻]
(1 p.)
= x² / (0,0155647 – x) = 1,6050955 · 10⁻¹⁰
(1 p.)
x = 1,58052 ·10⁻⁶ mol/l eller −1,58068 · 10⁻⁶ mol/l).
(1 p.)
(Den negativa roten accepteras inte eftersom koncentrationen inte kan vara negativ.)
[OH–] = 1,58052 · 10⁻⁶ mol/l
pOH = –log₁₀[OH–] = 5,8012
(1 p.)
pH = 14,0 − 5,8012 = 8,1988 ≈ 8,2
(1 p.)
7.2 Namnge någon annan typ av titrering och berätta vad observationen av ekvivalenspunkten utgår från i titreringen du namngivit. 3 p.
I svaret ska en metod nämnas (1 p.) och en förklaring till hur ekvivalenspunkten observeras ska ges (2 p.).
Till exempel:
-
Oxidations-reduktionstitrering/Redox-titrering, observationen av ekvivalenspunkten utgår från en förändring av färgen / spänningen / pH-värdet, som orsakas av föreningen som oxideras eller reduceras.
-
Utfällningstitrering, observationen av ekvivalenspunkten utgår från en förändring av färgen / av spänningen / av pH-värdet / som orsakas av att det inte bildas mera fällning.
-
Komplexometrisk titrering, observationen av ekvivalenspunkten utgår från en färgförändring som beror på en komplex förening som bildas eller som sönderfaller.
-
Konduktometrisk titrering, observationen av ekvivalenspunkten utgår från en förändring i den elektriska ledningsförmågan / spänningen.
-
Olika sorts syra-bastitreringar godkänns inte som svar.
8. Explosionen i Majak 15 p.
8.1
I avfallstanken skedde två huvudsakliga reaktioner: natriumnitratets sönderfallsreaktion och natriumacetatets förbränningsreaktion. I natriumnitratets sönderfallsreaktion bildades kväve, syre och natriumoxid. Förbränningsreaktionen skedde fullständigt och i förbränningen bildades enbart oxider av de grundämnen som natriumacetat är uppbyggt av.
Skriv reaktionsformlerna (reaktionslikheterna) för sönderfallsreaktionen och förbränningsreaktionen. Skriv sedan utifrån de här reaktionsformeln för totalreaktionen då man vet att allt syre som bildas i natriumnitrats sönderfallsreaktion förbrukas i natriumacetats förbränningsreaktion.
9 p.
Förbränningsreaktionen:
2CH₃COONa(s) + 4O₂(g) → 4CO₂(g) + 3H₂O(g) + Na₂O(s)
(3 p.)
-
Rätt ämnen 1 p., rätt koefficienter 1 p. och rätt aggregationstillstånd 1 p.
-
Om något felaktigt ämne ingår i reaktionsformeln, 0 p. för hela reaktionsformeln.
Sönderfallsreaktionen:
4NaNO₃(s) → 2Na₂O(s) + 2N₂(g) + 5O₂(g)
(3 p.)
-
Rätt ämnen 1 p., rätt koefficienter 1 p. och rätt aggregationstillstånd 1 p.
-
Om något felaktigt ämne ingår i reaktionsformeln, 0 p. för hela reaktionsformeln.
Totalreaktionen:
16NaNO₃(s) + 10CH₃COONa(s) → 20CO₂ (g) + 13Na₂O (s) + 15H₂O (g) + 8N₂(g)
(3 p.)
-
Rätt ämnen 1 p., rätt koefficienter 2 p.
-
Om något felaktigt ämne ingår i reaktionsformeln, 0 p. för hela reaktionsformeln.
-
Poängen för koefficienterna i totalreaktionen kan inte ansamlas om det finns felaktiga koefficienter i förbrännings- eller sönderfallsreaktionen.
8.2
Före explosionen hade allt vatten avdunstat ur tanken. Den fasta blandningen som då blev kvar innehöll 22,2 massprocent natriumacetat. Därtill bestod 75,8 massprocent av en blandning av natriumnitrat och kaliumdikromat. Anta att andelen kaliumdikromat är så liten i blandningen att den inte behöver beaktas i beräkningen.
Motivera med beräkningar vilketdera av utgångsämnena som var den begränsande faktorn i reaktionen.
6 p.
M(NaNO₃) = (22,99 + 14,01 + 3 · 16,00) g/mol = 85,00 g/mol
M(NaCH₃COO) = (22,99 + 2 · 12,01 + 2 · 16,00 + 3 · 1,008) g/mol = 82,034 g/mol
(1 p.)
Vi betecknar blandningens totala massa med x.
m(NaNO₃) = 0,758 · x
m(NaCH₃COO) = 0,222 · x
(1 p.)
n(NaNO₃) = m(NaNO₃) /M(NaNO₃)
= 0,758 · x / 85,00 g/mol
= 8,917647 mmol/g · x
n(NaCH₃COO) = m(NaCH₃COO) / M(NaCH₃COO)
= 0,222 · x / 82,034 g/mol
= 2,706195 mmol/g · x
(1 p.)
Utifrån de stökiometriska koefficienterna får vi
n(NaNO₃) / n(NaCH₃COO) = 16/10 = 8/5
n(NaNO₃) = 8/5 · n(NaCH₃COO).
(1 p.)
-
Om felaktiga stökiomeriska koefficienter har använts i beräkningen, 0 p. och ansamlingen av poäng avslutas.
Vi bestämmer med en beräkning om det finns tillräckligt stor mängd natriumacetat i förhållande till mängden natriumnitrat, med beaktande av de stökiometriska proportionerna:
8/5 · n(NaCH₃COO) = 8/5 · 2,706195 mmol/g · x = 4,329912 mmol/g · x
Utifrån resultatet kan vi se att det finns natriumnitrat i överskott i förhållande till mängden natriumacetat.
ELLER
8,917647 mmol/g · x / (2,706195 mmol/g · x) = 3,29527
Utifrån resultatet ser vi att 3,29527 > 8/5 och därmed finns det natriumnitrat i överskott i förhållande till mängden natriumacetat.
(1 p.)
Natriumacetatet är alltså den begränsande faktorn.
(1 p.)
Ett alternativt sätt att lösa uppgiften
Vi antar att vi har 100 g av blandningen.
Då gäller
m(NaNO₃) = 75,8 g och m(CH₃COONa) = 22,2 g,
så vi har
n(NaNO₃) = 0,8917646 mol och n(CH₃COONa) = 0,2706195 mol.
(3 p.)
Utifrån de stökiometriska koefficienterna får vi
n(NaNO₃) / n(NaCH₃COO) = 16/10 = 8/5
n(NaNO₃) = 8/5 · n(NaCH₃COO).
(1 p.)
-
Om felaktiga stökiomeriska koefficienter har använts i beräkningen, 0 p. och ansamlingen av poäng avslutas.
Bestämning av den begränsande faktorn:
Vi bestämmer med en beräkning om det finns en tillräckligt stor mängd natriumacetat i förhållande till mängden natriumnitrat, med beaktande av de stökiometriska proportionerna:
8/5 · n(NaCH₃COO) = 8/5 · 0,2706195 mol = 0,4329912 mol
Utifrån resultatet kan vi se att det finns natriumnitrat i överskott i förhållande till mängden natriumacetat. Natriumacetatet är alltså den begränsande faktorn.
ELLER
0,891 764 7 mol / (0,2706195 mol) = 3,29527
Utifrån resultatet ser vi att 3,29527 > 8/5.
Det finns alltså natriumnitrat i överskott i förhållande till mängden natriumacetat.
(1 p.)
Natriumacetatet är alltså den begränsande faktorn.
(1 p.)
Del 3: 20-poängsuppgifter
9. Syntes av resorcylsyra 20 p.
Aromatiska substitutionsreaktioner kräver ofta reagens som är starka och frätande. I en substitutionsreaktion substitueras en väteatom i en aromatisk ring, men i övrigt förblir molekylens stam oförändrad. För resorcinol kan man ändå åstadkomma en substitutionsreaktion under väldigt milda förhållanden genom att värma upp en vattenlösning av resorcinol och natriumvätekarbonat. Det ska finnas natriumvätekarbonat i överskott i reaktionsblandningen.
Syntesen av resorcylsyra omfattar två skeden enligt schemat invid. I skede 1 bildas först natriumresorcylat. I skede 2 avkyls reaktionsblandningen och man tillsätter saltsyra (vattenlösning av HCl). Då kristalliseras slutprodukten, alltså resorcylsyran, ur blandningen som fina kristaller. Resorcylsyra är svårlöslig i kallt vatten.
13C-NMR-spektroskopi utnyttjades för att säkerställa produktens struktur. I ett vanligt 13C-NMR-spektrum uppkommer en topp för varje kolatom som har en viss kemisk omgivning. I produktens 13C-NMR-spektrum kunde man se toppar vid följande kemiska skift: 172,3; 164,3; 163,7; 132,4; 108,5; 104,8 och 102,7 ppm. Inga andra toppar kunde ses. I utgångsämnets, alltså resorcinolens, 13C-NMR-spektrum kunde man se följande toppar: 160,1; 131,5; 107,7 och 104,2 ppm.
Du kan utnyttja filerna och då du utför deluppgifterna.
9.1 Reaktionsformlerna för skede 1 och 2 är inte balanserade och i vardera saknas en eller flera reaktionsprodukter. Skriv de kemiska formlerna för de produkter som saknas och ange deras namn. 4 p.
Skede 1: vatten (1 p.) H₂O (1 p.).
Skede 2: natriumklorid (1 p.) NaCl (1 p.).
-
För alla namn och formler gäller att ett felaktigt namn eller en felaktig formel upphäver poängen för ett korrekt namn eller en korrekt formel.
9.2
Resorcylsyran som kristalliserats ur reaktionsblandningen separeras från de övriga ämnena i reaktionsblandningen, såsom kvarblivna utgångsämnen, lösningsmedel och salter. Som produkt erhålls till slut ren och torr resorcylsyra.
Beskriv en metod som används i laboratoriet samt de redskap som behövs för att separera resorcylsyran som bildats så att produkten är ren och torr.
5 p.
Resorcylsyran som erhålls som produkt separeras genom filtrering/sugfiltrering.
(2 p.)
-
Även centrifugering godkänns.
-
Andra metoder, som exempelvis dekantering, 0 p. för hela deluppgiften. Om rätt metod och fel metod har beskrivits, 0 p. för hela deluppgiften.
Som redskap används en filtrertratt eller en (Büchner)tratt och filtrerpapper.
(1 p.)
Produkten tvättas (sköljs) med kallt vatten
(1 p.)
-
Vid tvätten måste man använda vatten.
och produkten får torka (till exempel på filtrerpapper) i luft eller i ett värmeskåp.
(1 p.)
-
Om torkningen utförs genom upphettning, till exempel med gasbrännare, 0 p.
9.3 Motivera med hjälp av strukturen för resorcinolmolekylen varför 13C-NMR-spektrumet för resorcinol har bara fyra toppar fast det finns sex kolatomer i resorcinolmolekylen. Använd de siffror för kolatomerna som är markerade i uppgiftsformuleringens bild som hjälp då du svarar. 3 p.
Kolatomerna 1 och 3 i resorcinolmolekylen har en likadan kemisk omgivning.
(1 p.)
Detsamma gäller för kolatomerna 4 och 6.
(1 p.)
-
Man kan också utyttja MarvinSketch-programmet för att modellera spektrumen och bestämma antalet kemiska omgivningar.
Fyra olika kemiska omgivningar ger upphov till fyra toppar i spektrumet.
ELLER
Kolatomer som finns i likadana kemiska omgivningar ger upphov till en topp i spektrumet.
ELLER
De övriga två kolatomerna ger vardera upphov till en topp.
(1 p.)
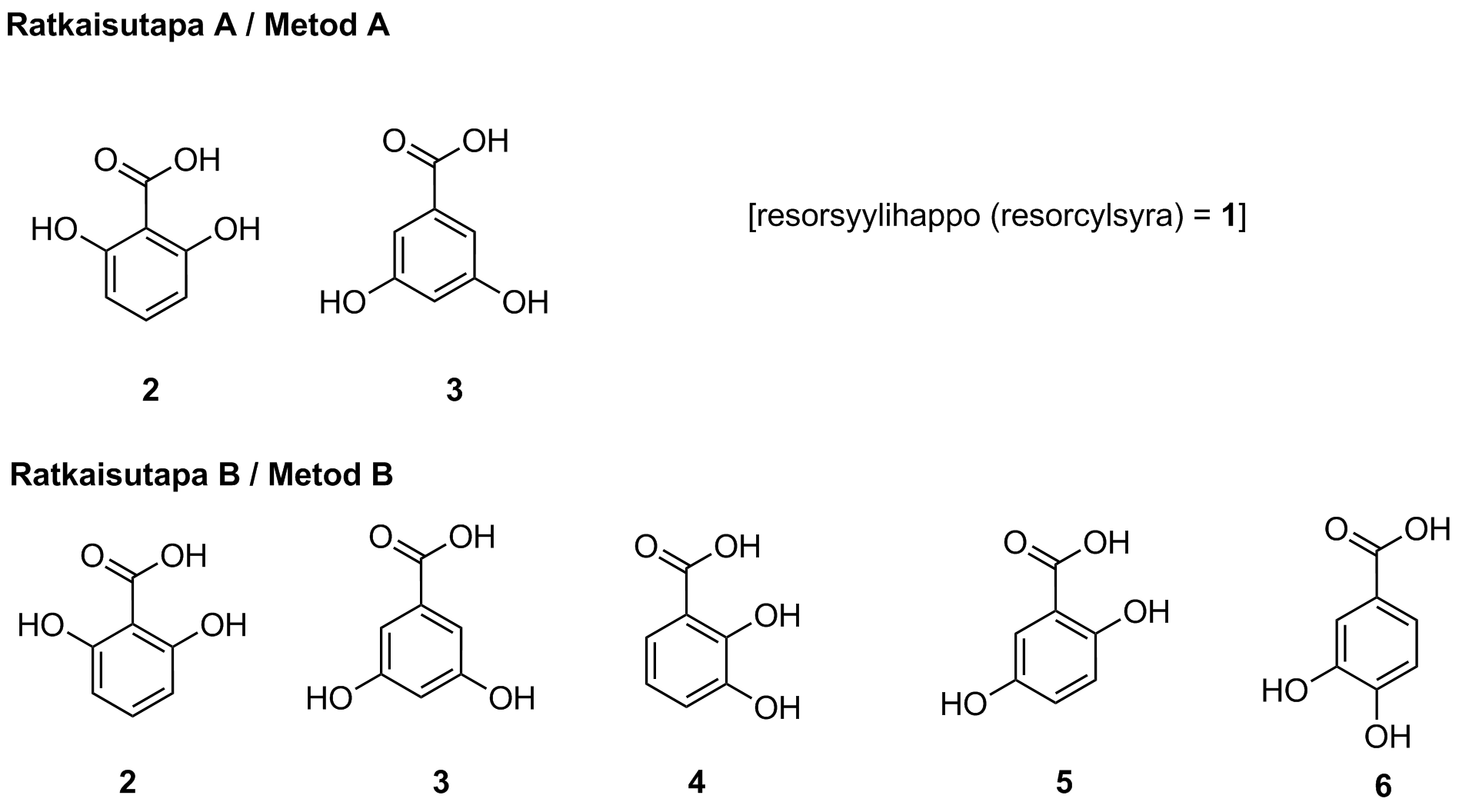
9.4 I syntesen av resorcylsyra kan det också bildas ställningsisomerer till produkten. Rita strukturerna för alla ställningsisomerer till resorcylsyra. Motivera vidare med hjälp av 13C-NMR-spektrumet för produkten varför den erhållna produkten inte kan vara någon av resorcylsyrans ställningsisomerer. 8 p.
Uppgiften kan lösas på två olika sätt. Metod A utgår från bara de ställningsisomerer (2 och 3) som kan bildas i reaktionen. Metod B utgår från alla möjliga ställningsisomerer. Om minst en av isomererna 4–6 ingår i svaret följer poängsättningen metod B. I andra fall används metod A.
Metod A:
Strukturerna 2 och 3 har ritats upp.
(4 p.)
-
Om bara ena strukturen är rätt, 2 p. och poängansamlingen avslutas. Då kan poäng inte ansamlas för förklaringsdelen.
-
Varje felaktig struktur, överlopps struktur eller upprepning av en tidigare ritad struktur upphäver förtjänsten för en rätt struktur.
-
Om reaktionsprodukten 1 har ritats en eller flera gånger görs inget poängavdrag.
I båda ställningsisomererna finns det kolatomer i fem olika kemiska omgivningar
(1 p.)
så i vardera isomerens ¹³C-NMR-spektrum finns det bara fem toppar.
(1 p.)
-
Den här poängen kan förtjänas genom att modellera båda isomerernas ¹³C-NMR-spektrum med MarvinSketch-programmet och sedan konstatera att båda spektrumen innehåller fem toppar.
I ¹³C-NMR-spektrumet för produkten finns det ändå sju toppar så ingendera av de här ställningsisomererna kan vara den ifrågavarande produkten.
(2 p.)
-
De sista 2 p. kan ansamlas bara om åtminstone den ena av de två föregående poängen har förtjänats.
-
Poängen kan också ansamlas genom att modellera ¹³C-NMR-spektrumen för strukturerna 1–3 med MarvinSketch-programmet och sedan konstatera att topparna i ¹³C-NMR-spektrumen för isomererna 2 och 3 är på olika ställen jämfört med topparna i ¹³C-NMR-spektrumet för reaktionsprodukten 1.
Metod B:
Strukturerna 2–6 har ritats upp.
(4 p.)
-
Alla fem isomerer ska vara rätt för att poängen för förklaringen ska ansamlas. Poängansamlingen avslutas efter strukturformlerna om en eller flera isomerer saknas eller är fel eller upprepas i svaret.
-
Fyra isomerer rätt 3 p., tre isomerer rätt 2 p., två isomerer rätt 1 p.
-
Varje felaktig struktur, överlopps struktur eller upprepning av samma struktur upphäver förtjänsten för en rätt struktur.
-
Om reaktionsprodukten 1 har ritats en eller flera gånger görs inget poängavdrag.
I isomererna 2 och 3 finns det kolatomer i fem olika kemiska omgivningar
(1 p.)
och därmed finns det bara fem toppar/ kemiska skift i vardera isomerens ¹³C-NMR-spektrum.
(1 p.)
-
Den här poängen kan även förtjänas genom att modellera isomerernas ¹³C-NMR-spektrum med MarvinSketch-programmet.
¹³C-NMR-spektrumen för isomererna 4–6 har modellerats med MarvinSketch-programmet.
(1 p.)
Inget av de här modellerade spektrumen motsvarar ¹³C-NMR-spektrumet för produkten 1.
(1 p.)
-
Poängen kan bara ansamlas om minst den ena poängen för ¹³C-NMR-spektrumen för isomererna 2 och 3 har förtjänats och poängen för ¹³C-NMR-spektrumen för isomererna 4–6 har förtjänats.
10. Ångtryck och ångbildningsentalpi 20 p.
10.1 Ångbildningsentalpin för vatten är 40,66 kJ/mol. Ge en kemisk motivering till att ångbildningsentalpin för vatten är större än för aceton. 4 p.
En vattenmolekyl bildar vätebindningar till andra vattenmolekyler.
(1 p.)
En acetonmolekyl bildar dipol-dipolbindningar till andra acetonmolekyler
(1 p.)
Vätebindningar är kraftigare än dipol-dipolbindningar.
(1 p.)
-
Den här poängen kan ansamlas bara om de föregående poängen ansamlats.
Därför är bindningarna mellan vattenmolekyler kraftigare och det krävs mer energi för att vatten ska förångas.
(1 p.)
-
Den här poängen kan ansamlas bara om de föregående poängen ansamlats. För att poäng ska ansamlas förutsätts dessutom att vätebindningarna och dipol-dipolbindningarna har konstaterats vara mellan molekyler.
10.2 Rita upp en graf utifrån värdena i tabell och bestäm ångbildningsentalpin för aceton med hjälp av grafen. 8 p.
Skärmdump av en exempelgraf som är ritad med Geogebra.
Grafen har ritats upp:
-
1/T-värdena har räknats rätt (1 p.)
-
Om den vågräta axeln har värdena för temperaturen T istället för (1/T)-värden, 0 p. för hela deluppgiften.
-
-
Axlarna är ritade i rätt ordning och rätt storheter har markerats på båda axlarna. (1 p.)
-
En rät linje har anpassats till mätpunkterna. (1 p.)
Ekvationen för den anpassade linjen:
y = −3850,651 · x + 16,341
(1 p.)
- Det räcker att granska riktningskoefficienten.
- Det numeriska värdet för riktningskoefficienten ska vara inom intervallet –3852 – –3837.
\mathrm{Riktningskoefficienten}=-\frac{\Delta H_{\mathrm{vap}}}{R}=-3\ 850{,}651\ \mathrm{K}
(1 p.)
\Delta H_{\mathrm{vap}}=R\cdot3\ 850{,}651\ \mathrm{K}=8{,}314463\frac{\mathrm{J}}{\mathrm{K\cdot mol}}\cdot3\ 850{,}651\ \mathrm{K}=32{,}0161\ \mathrm{kJ/mol}\approx32{,}02\mathrm{kJ/mol}
(3 p.)
10.3 Vid härledningen av Clausius–Clapeyron-ekvationen i material antar man att värdet för ångbildningsentalpin inte beror på temperaturen. I verkligheten minskar ångbildningsentalpins värde vanligen något då temperaturen ökar. Motivera varför ett ämne förångas lättare då temperaturen stiger. 4 p.
En höjning av temperaturen leder till att en del av bindningarna mellan molekylerna i vätskan brister.
ELLER
Den kinetiska energin för molekylerna i vätskan blir större.
(2 p.)
Därmed kräver ångbildningen mindre (tilläggs)energi.
ELLER
Därmed kan molekylerna lättare övergå i gasfas.
(2 p.)
10.4 Om huden av misstag kommer i kontakt med aceton känns huden sval. Det här har att göra med den låga kokpunkten (56 °C) hos aceton och på att aceton avdunstar effektivt från hudens yta. Motivera vad den av acetonet orsakade nedkylningen av huden beror på. 4 p.
Ångbildning är en endoterm process vilket innebär att processen binder värmeenergi
(2 p.)
från omgivningen/huden och förångningen av acetonet sänker hudens temperatur.
(2 p.)
11. Bestämning av en empirisk formel 20 p.
Den empiriska formeln (CxHyNz) för en okänd förening bestämdes med hjälp av två experiment.
Experiment 1 utgår från sönderfallsreaktionen i vilken 0,1500 g av den okända föreningen (CxHyNz) fick sönderfalla. I reaktionen bildades 16,4 ml kvävgas (t = 27,0 °C och p = 97 300 Pa). I det här experimentet omvandlades allt kväve i föreningen till kvävgas.
Upplägget för experiment 2 visas i bilden invid.
I experiment 2 tog man ett prov med massan 0,2000 g av samma förening och förbrände provet. Produkterna från den fullständiga förbränningen i experiment 2 leddes genom två rör. Det första röret var fyllt med kalciumklorid och det andra röret var fyllt med kaliumhydroxid. Massan för röret som var fyllt med kalciumklorid ökade med 0,1078 g. Massan för röret som var fyllt med kaliumhydroxid ökade med 0,6026 g.
11.1
Vad var orsaken till ökningen av massorna i rören som var fyllda med kalciumklorid och kaliumhydroxid? Utnyttja följande reaktionsformler:
CaCl₂(s) + 2H₂O(g/l) → CaCl₂·2H₂O(s)
2KOH(s) + CO₂(g) → K₂CO₃(s) + H₂O(l)
I båda reaktionerna blev produkterna kvar i rören.
5 p.
2KOH(s) + CO₂(g) → K₂CO₃(s) + H₂O(l)
Vattnet som bildas i förbränningen av provet binds till kalciumkloriden
(1 p.)
som kristallvatten. Därför ökar massan för röret som innehåller kalciumklorid.
(1 p.)
Koldioxiden som bildas i förbränningsreaktionen reagerar med kaliumhydroxiden
(2 p.)
och då bildas det kaliumkarbonat och vatten. Därför ökar massan för röret som innehåller kaliumhydroxid. (1 p.)
-
Det ska framgå ur svaret att reaktionerna gäller rätt ämnen.
11.2 Bestäm den empiriska formeln för den okända föreningen (CxHyNz) utifrån experimenten. 15 p.
Experiment 1 (sönderfallsreaktionen):
n(N₂) = pV / RT = (97300 Pa · 0,0000164 m³) / (8,31446 Pa · m³/(K · mol) · 300,15 K) = 0,00063942 mol
(2 p.)
Experiment 2 (förbränningsanalysen):
Massan för röret som var fyllt med kalciumklorid ökade med 0,1078 g. Det här motsvarar massan för vattnet.
n(H₂O) = m(H₂O) / M(H₂O) = 0,1078 g / 18,016 g/mol = 0,0059836 mol
(2 p.)
Massan för röret som var fyllt med kaliumhydroxid ökade med 0,6026 g. Det här motsvarar massan för koldioxiden.
n(CO₂) = m(CO₂) / M(CO₂) = 0,6026 g / 44,01 g/mol = 0,013692 mol
(2 p.)
Vi kombinerar resultaten:
I sönderfallsreaktionen (experiment 1) användes 0,1500 g av den okända föreningen medan 0,2000 g av föreningen användes i förbränningsanalysen (experiment 2). Om man hade använt samma massa i sönderfallsreaktionen som i förbränningsreaktionen skulle mängden kväve som bildats ha varit:
n(N₂) = 0,00063941 mol · (0,2000 g / 0,1500 g) = 0,00085256 mol.
(2 p.)
n(N₂) = 0,00085256 mol
n(CO₂) = 0,013692 mol
n(H₂O) = 0,0059836 mol
Vi omvandlar de här substansmängderna till substansmängder för grundämnesatomerna:
n(N) = 2 · n(N₂) = 2 · 0,00085256 mol = 0,0017051 mol
-
Om sönderfallsreaktionen inte alls har använts som grund för svaret utan kvävets substansmängd har istället beräknats via förbränningsreaktionsexperimentet ansamlas inte de föregående poängen som hör ihop med bestämningen av kväve. Resten av poängen i uppgiften kan ändå ansamlas.
n(C) = n(CO₂) = 0,013692 mol
n(H) = 2 · n(H₂O) = 2 · 0,0059836 mol = 0,01196714 mol
(4 p.)
-
Alla tre substansmängder rätt 4 p., två rätt 2 p. och om bara en är rätt, 1 p.
Sedan dividerar vi de erhållna värdena med den minsta substansmängden (n(N) = 0,0017051 mol):
N: 1
C: 0,013692 mol / (0,0017051 mol) = 8,03
(1 p.)
H: 0,011967 mol / (0,0017051 mol) = 7,02
(1 p.)
Den empiriska formeln är C₈H₇N (eller (C₈H₇N)ₓ).
(1 p.)
-
Om den empiriska formeln har kallats för molekylformel erhålls inte den sista poängen.
(Föreningen i fråga kunde till exempel vara indol.)