Beskrivningar av goda svar: SV – Kemi
26.3.2025
Slutgiltiga beskrivningar av goda svar 13.5.2025
Grunderna enligt vilka bedömningen gjorts framkommer i de slutgiltiga beskrivningarna av goda svar. Uppgiften om hur bedömningsgrunderna tillämpats på examinandens provprestation utgörs av de poäng som examinanden fått för sin provprestation, de slutgiltiga beskrivningarna av goda svar och de föreskrifter gällande bedömningen som nämnden gett i sina föreskrifter och anvisningar. De slutgiltiga beskrivningarna av goda svar innehåller och beskriver inte nödvändigtvis alla godkända svarsalternativ eller alla godkända detaljer i ett godkänt svar. Eventuella bedömningsmarkeringar i provprestationerna anses vara jämställbara med anteckningar och sålunda ger de, eller avsaknaden av markeringar, inte direkta uppgifter om hur bedömningsgrunderna tillämpats på provprestationen.
Med studentexamensprovet utreds om studerandena tillägnat sig de kunskaper och färdigheter som anges i gymnasiets läroplan och uppnått tillräcklig mognad enligt målen för gymnasieutbildningen. Målet för bedömningen i läroämnet kemi är en förståelse för och en tillämpning av den kemiska kunskapen. Vid bedömningen beaktas även de färdigheter med vilka man tillägnar sig experimentell kunskap och förmågan att behandla den. Till sådan kunskap hör till exempel planering av experiment, trygg hantering av arbetsredskap och reagens, presentation och tolkning av resultat samt förmågan att dra slutsatser och tillämpa dem.
Vid bedömningen av uppgifterna i kemi läggs vikten vid ett framställningssätt som betonar läroämnets karaktär och vid precision i begreppen och språkbruket. Reaktionsformlerna ställs upp utan oxidationstal med minsta möjliga heltalskoefficienter och med aggregationstillstånden angivna. I organiska reaktionslikheter används strukturformler, men aggregationstillstånd krävs inte. Olika sätt att skriva strukturformler godkänns.
I beräkningsuppgifter ska storhetsekvationer och formler användas på ett sätt som visar att examinanden förstått uppgiften rätt och tillämpat korrekt princip eller lag i sin lösning. Av svaret framgår entydigt hur man når slutresultatet, men omfattande mellansteg behövs inte. CAS-program kan utnyttjas i uppgiftens olika skeden. De principer och lagar som gäller den aktuella situationen samt uppgiftens slutresultat och de slutsatser som dras utgående från lösningen är av central betydelse och ska framgå av svaret. Slutresultaten ges med enheter och med den noggrannhet som utgångsvärdena kräver, och slutsatserna motiveras.
Mätresultat och grafer som ritats utgående från dessa utnyttjas vid analysen av data och då man drar slutsatser. Till mätpunkterna anpassas en vederbörlig rät linje Värden som ligger mellan mätpunkterna kan interpoleras med ögonmått genom visuell avläsning av grafen eller med hjälp av ett lämpligt program. Axlarnas namn, enheter och skala märks ut i grafen. I grafen anges sådana punkter som är väsentliga för slutsatserna, som ekvivalenspunkten för en titrerkurva eller tangenten som används när man beräknar en hastighet vid en given tidpunkt.
I essäsvar och förklarande svar kompletteras texten med reaktionsformler, ekvationer eller teckningar. Fenomenen som behandlas beskrivs på makroskopisk, mikroskopisk och symbolisk nivå. Av svaret framgår att det material som hör ihop med uppgiften har använts, tillämpats, analyserats och utvärderats i enlighet med uppgiftsformuleringen. Ett svar på god nivå är välstrukturerat och innehållsmässigt konsekvent.
Svaren bedöms enligt de kriterier som gäller för respektive uppgift. Utgångspunkten vid bedömningen är de förtjänster för vilka poäng ansamlas. Om en central kemisk princip saknas eller är felaktig avslutas poängansamlingen. Då godkänns inte fortplantning av det felaktiga resultatet (ej-FF). Exempel på sådana fel är stökiometrifel, fel begränsande faktor samt fel ämne i en reaktionslikhet. För övriga brister eller fel godkänns fortplantning av det felaktiga resultatet (FF), och då fortsätter ansamlingen av poäng efter bristfälligheten eller felet. I de krävande uppgifterna i provets del 3 förutsätts en större precision i behandlingen av principer än i de grundläggande uppgifterna i början av provet. Ur kemisk synvinkel inexakt språkbruk, små räknefel eller slarvig användning av närmevärden orsakar avdrag på 0–3 p. till exempel på följande sätt:
- avrundnings- och kopieringsfel som inte påverkar slutresultatet, −0 p.
- kopieringsfel, avrundningsfel och små slarvfel som påverkar slutresultatet, ett enskilt litet fel i en strukturformel, −1 p.
- enhetsomvandlingsfel, systematiska fel i en strukturformel samt övriga fel som till sin natur är allvarligare än små fel, men där det ändå inte är fråga om en felaktig kemisk princip, −2 p.
Del 1: 20-poängsuppgift
1. Flervalsuppgifter från kemins olika delområden 20 p.
1.1 Vilken av följande metaller är en vätska vid vanliga laboratorieförhållanden? 2 p.
- kvicksilver (2 p.)
1.2 Vilken av följande föreningar är en aldehyd? 2 p.
- propanal (2 p.)
1.3 Vilken av följande lösningar är basisk? 2 p.
- NaOH(aq) (2 p.)
1.4 Då en gasflaska upphettas gäller följande för gasen i gasflaskan: 2 p.
- trycket ökar. (2 p.)
1.5 Alla metaller 2 p.
- leder elektricitet. (2 p.)
1.6 I polysackarider binds monosackariderna till varandra med 2 p.
- glykosidbindningar. (2 p.)
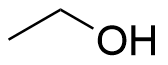
1.7 Vilka förändringar i aggregationstillstånd sker då etanol separeras från vatten genom destillering? 2 p.
- Vätska övergår till gas och tillbaka till vätska. (2 p.)
1.8 Vilken förening bildas som huvudprodukt då but-1-en och vätebromid reagerar i en additionsreaktion? 2 p.
- 2-brombutan (2 p.)
1.9 I en kemisk reaktion frigörs alltid energi då 2 p.
- bindningar bildas. (2 p.)
1.10 I en viss reaktion ökas utgångsämnets koncentration och reaktionens hastighet blir då större. Det här beror på att 2 p.
- antalet kollisioner mellan molekylerna blir större. (2 p.)
Del 2: 15-poängsuppgifter
2. Sönderfallsreaktionen för kaliumklorat 15 p.
2.1
Kaliumklorat KClO₃ i fast form kan sönderfalla i en snabb exoterm reaktion till kaliumklorid KCl i fast form och syrgas O₂. Skriv den balanserade reaktionsformeln (reaktionslikheten).
I ett laboratorieexperiment undersökte man den här sönderfallsreaktionen. Som utgångsämne använde man 2,34 gram kaliumklorat. Hur många gram syrgas bildades?
10 p.
2KClO₃(s) → 2KCl(s) + 3O₂(g)
(3 p.)
-
Rätt ämnen, 1 p.
-
Därtill rätt aggregationstillstånd, 1 p, och rätt koefficienter, 1 p.
m(KClO₃) = 2,34 g
M(KClO₃) = 122,55 g/mol
(1 p.)
M(O₂) = 32,00 g/mol
(1 p.)
n(KClO₃) = m/M = (2,34 g) / (122,55 g/mol) = 0,019094 mol
(1 p.)
n(O₂) = 3/2 · n(KClO₃) = 3/2 · 0,019094 mol = 0,028641 mol
(2 p.)
-
Om det stökiometriska förhållandet är fel avslutas ansamlandet av poäng.
m(O₂) = n · M = 0,028641 mol · 32,00 g/mol = 0,91652 g ≈ 0,917 g
-
Som svar godkänns också 0,92 g och 0,9165 g. Annan siffernoggrannhet, −1 p.
(2 p.)
2.2 Kaliumklorat kan användas som en beståndsdel i den tändande änden av en tändsticka. Vilken roll spelar kaliumkloratet då tändstickan tänds? Motivera ditt svar kemiskt. 2 p.
Tändstickan antänds och förbränningsreaktionen blir kraftigare eftersom sönderfallet av kaliumklorat är en snabb reaktion som frigör värme/energi.
(1 p.)
-
Det räcker inte att nämna att reaktionen är exoterm. Den informationen är given i uppgiften.
I sönderfallsreaktionen frigörs syrgas. Syret gör förbränningen effektivare.
(1 p.)
Kommentar: I verkligheten är tändstickans antändning en komplicerad process som involverar ett flertal ämnen. Poängsättningen för den här uppgiften utgår från uppgiftsformuleringen och kunskap på gymnasiekemins nivå.
2.3 Är sönderfallsreaktionen för kaliumklorat en reduktions-oxidationsreaktion (redox-reaktion)? Motivera ditt svar. 3 p.
Kaliumkloratets sönderfallsreaktion är en reduktions-oxidationsreaktion.
(1 p.)
-
Enbart oxidationsreaktion eller reduktionsreaktion godkänns inte.
(Oxidationstalen, eller oxidationstillstånden, förändras för de ämnen som reagerar.)
Oxidationstalet för klor förändras från +5 i utgångsämnena till −1 i produkterna.
(1 p.)
Oxidationstalet för syre förändras från −2 i utgångsämnena till 0 i produkterna.
(1 p.)
3. Framställning av ett läkemedel mot epilepsi 15 p.
3.1 Namnge de funktionella grupperna som är inringade i föreningarna O, P och Q i reaktionsformeln. 3 p.
O: aminogrupp, P: estergrupp, Q: amidgrupp
(3 p.)
-
Poängsättning: 1 p. / rätt grupp
-
Amin godkänns inte som namn för grupp O.
3.2 Identifiera föreningarna R och S. Skriv namnet eller rita strukturformeln för vardera föreningen. 4 p.
3.3 Istället för levetiracetam (Q) vill en forskare framställa föreningens andra enantiomer (spegelbildsisomer). Då ska forskaren i stället för föreningen O använda en annan förening som utgångsämne. Rita strukturformeln för den här andra föreningen. 4 p.
3.4 Föreningen O kan framställas utgående från en aminosyra då aminosyrans karboxylgrupp omvandlas till en amidgrupp. Rita strukturformeln för den här aminosyran. 4 p.
4. Färgämnen i blad 15 p.
4.1 Förklara varför bladen mals i en mortel i steg 1. Förklara varför provet omrörs och varför man väntar 30 minuter. Namnge den separationsmetod som används. 3 p.
Då de strimlade bladen mals i morteln blir de mer finfördelade och växtcellerna går sönder.
ELLER
Då de strimlade bladen mals i morteln löser sig färgämnena lättare under extraktionen. (1 p.)
-
Enbart en beskrivning av att bladet blir mer sönderdelat eller finfördelat, att färgämnena blandas med vatten, eller att bladet löser sig, 0 p.
Då provet rörs om i dekanterglaset löser sig/extraheras färgämnena lättare från bladen till vattenlösningen.
ELLER
Efter omrörningen väntar man i 30 minuter för att så mycket som möjligt ska hinna lösa sig.
(1 p.)
Namnet på det första skedet är (fast fas-vätske)extraktion. (1 p.)
4.2 Beskriv vad man gör i steg 2. Namnge den separationsmetod som används. 2 p.
(Lösningen filtreras med en büchnertratt till en sugflaska.) Då blir de fasta lövstrimlorna kvar i tratten och vattenlösningen med färgämnena rinner ned i sugflaskan. (1 p.)
-
Istället för lösningen nämns enbart vatten eller färgämnen, 0 p.
Separationsmetoden som används i den andra fasen är (sug)filtrering. (1 p.)
4.3 Förklara vad som händer i videon. Namnge separationsmetoden och berätta vilken kemisk egenskap som ligger till grund för separationen av färgämnena. 5 p.
Det är fråga om vätske-vätskeextraktion. (1 p.)
Metoden utgår från att ämnena som ska separeras från varandra löser sig på olika sätt i lösningsmedlen som används i vätske-vätskeextraktionen. (1 p.)
Högst 3 p. ansamlas av följande. Förklaringen krävs för poäng:
-
Vattenlösningen som innehåller färgämnen hälls i en separationstratt och dietyleter tillsätts.
-
Förklaring: Dietyletern löser sig inte i vatten. / Dietyletern löser sig bara lite i vatten(, så det bildas två lager). (1 p.)
-
-
Extraktionstratten omskakas
-
Förklaring: Det ger en större gränsyta mellan de två lösningsmedlen. / Det gör att de ämnen som är lösliga i dietyleter löser sig snabbare i dietyleterfasen. (1 p.)
-
-
Extraktionstrattens kran öppnas för en stund.
-
Förklaring: Gasen som har bildats släpps ut. / Trycket utjämnas. (1 p.)
-
-
Den nedre fasen tappas ut från separationstratten. Den övre fasen hälls via separationstrattens övre öppning i en annan erlenmeyerkolv.
-
Förklaring: Fasen med högre densitet är nedtill. / Fasen med lägre densitet är den övre fasen. (1 p.)
-
Förklaring: Vattenfasen är den nedre fasen. / Vattenfasen är rödbrun. / Eterfasen är den övre fasen. / Eterfasen är gul. (1 p.)
-
4.4 Provet i video innehåller två gula färgämnen: luteolin och betakaroten. I bild visas de här föreningarnas strukturformler. Motivera med hjälp av föreningarnas strukturer om de här föreningarna separeras i skilda lösningar i video . 5 p.
Luteolin är polärt (1 p.). Luteolin innehåller syreatomer / polära OH-grupper / (fenoliska) hydroxigrupper / en karbonylgrupp / en etergrupp (1 p.) som kan bilda dipol-dipolbindningar eller vätebindningar med vattenmolekyler (1 p.). Luteolin löser sig därmed väl i vatten som är polärt, men sämre i den opolära dietyletern.
Betakaroten är opolärt. / Betakaroten består däremot enbart av kol och väte och innehåller inte några polära grupper. (1 p.) Det löser sig därför bättre i den opolära dietyleterfasen. (1 p.)
5. Den slarviga forskaren 15 p.
5.1 Först bestämde sig forskaren för att utföra en grundämnesanalys för att bestämma föreningarnas grundämnessammansättning i massprocent. Apparaten var dock på service så forskaren kunde inte utföra analysen. Hade det varit möjligt att para ihop innehållet i varje burk med rätt struktur med hjälp av grundämnesanalysen? Motivera ditt svar. 4 p.
Föreningarna L och M är strukturisomerer till varandra.
ELLER
Föreningarna L och M är har samma molekylformel / empiriska formel.
(2 p.)
Därför kan man inte bestämma vilken förening som finns i de olika burkarna med grundämnesanalys.
ELLER
Föreningarna L och M kan därför inte separeras från varandra med grundämnesanalys.
ELLER
Förening K har en annorlunda sammansättning i massprocent jämfört med föreningarna L och M, så man skulle ändå kunna identifiera föreningen K.
(2 p.)
-
De sista 2 p. kan erhållas bara om de föregående 2 p. har erhållits.
5.2 Forskaren löste upp en liten mängd av varje förening i vatten och mätte pH-värdena för vattenlösningarna som bildades. Vattenlösningen av föreningen i burk A var något sur medan vattenlösningen med föreningen i burk B var något basisk. Föreningen i burk C förändrade inte pH-värdet för vattenlösningen. Vilken burk innehöll vilken förening? Motivera ditt svar med hjälp av föreningarnas strukturer. 6 p.
Poängsättning: Rätt kombination av ämne och burk 1 p./förening, rätt motivering, 1 p. / förening.
Burk B innehöll föreningen K. / Lösningen i burk B var basisk. (1 p.)
Förening K innehåller en aromatisk aminogrupp och är därmed en svag bas. (1 p.)
Burk A innehöll föreningen L. / Lösningen i burk A var sur. (1 p.)
Förening L innehåller en fenolisk hydroxigrupp och är därmed en svag syra. (1 p.)
Burk C innehöll föreningen M. / Föreningen i burk C hade ingen inverkan på vattenlösningens pH-värde. (1 p.)
Förening M innehåller inte några funktionella grupper som kan fungera som syra eller som bas i en vattenlösning. (1 p.)
5.3
Sedan uppmätte forskaren ¹H-NMR-spektrumet för var och en av föreningarna. Varför fanns det olika antal toppar i spektrumen för föreningarna K, L och M?
I spektrum 1 fanns det fyra toppar, i spektrum 2 fem toppar och i spektrum 3 sex toppar. Para ihop vart och ett av spektrumen 1, 2 och 3 med föreningarna K, L och M. Du behöver inte motivera kombinationerna.
5 p.
(Med hjälp av ¹H-NMR-spektroskopi kan man undersöka exciteringar hos ¹H-kärnorna.) Vätekärnor i en specifik kemisk miljö ger upphov till en topp på ett specifikt ställe i spektrumet (stället i spektrumet anges oftast med hjälp av det kemiska skiftet). (I förening K finns vätekärnor i fyra olika miljöer, i förening L i fem olika miljöer och i förening M i sex olika kemiska miljöer.) Därför är antalet toppar olika i de olika föreningarnas ¹H-NMR-spektrum. (2 p.)
-
Poängen kräver att svaret visar på föreståelse att olika antal toppar i spektrumet beror på olika antal kemiska miljöer för vätekärnorna.
Spektrum 1: förening K
Spektrum 2: förening L
Spektrum 3: förening M
(3 p.)
-
1 p. / rätt förening.
6. Smörsyra 15 p.
6.1 Butansyra är en svag syra som har pKₐ-värdet 4,82. Hur många gram butansyra ska man blanda i vatten för att pH-värdet för lösningen som bildas ska vara 5,10 då lösningens slutvolym är 1,00 liter? 10 p.
Lösningens pH = 5,10 och då får vi log₁₀[H₃O⁺] = −5,10.
[H₃O⁺] = 10−5,10 mol/l = 7,9433 ⋅ 10⁻⁶ mol/l
(1 p.)
Vi betecknar [H₃O⁺] = a. Sedan bestämmer vi koncentrationen för butansyra i början och betecknar den med x. Vi betecknar butansyran med HA.
Vi betraktar jämvikten:
| HA | + | H₂O | ⇌ | A⁻ | + | H₃O⁺ | |
| I början (mol/l) | x | 0 | 0 | ||||
| Vid jämvikt (mol/l) | x – a | a | a |
(2 p.)
-
Om jämviktsbetraktelsen är felaktig kan högst 4 p. erhållas för deluppgiften (oxoniumjonkoncentrationen, Kₐ-värdet, uttrycket för K, samt butansyrans molmassa).
pKₐ = 4,82 , så vi får Kₐ = 10−4,82
(1 p.)
Kₐ = [H₃O⁺] [A⁻] / [HA]
(1 p.)
-
Om pKₐ-värdet används istället för Kₐ-värdet avslutas ansamlingen av poäng (ej-FF).
= a² / (x–a)
(x-a) = a² / Kₐ
(1 p.)
x = a² / K + a = (10−5,10)² / 10−4,82 + 10−5,10 = 1,2112 ⋅ 10⁻⁵ (mol/l)
(1 p.)
m(HA) = n(HA) ⋅ M(HA) = (c(HA) · V) ⋅ M(HA)
M(HA) = 4 ⋅ 12,01 g/mol + 2 ⋅ 16,00 g/mol + 8 ⋅ 1,008 g/mol = 88,104 g /mol
(1 p.)
m(HA) = n(HA)·M(HA) = c(HA)·V·M(HA) = (1,2112 · 10⁻⁵ mol/l · 1,00 l) ⋅ 88,104 g /mol = 1,0671156 mg
Vi ska tillsätta 1,07 mg butansyra i vattnet. (2 p.)
-
Som enhet godkänns både gram och milligram.
6.2 Joner avdunstar i mycket liten grad ur lösningar. Därför beror lukten av butansyra främst på koncentrationen av oladdade molekyler i lösningen. En studerande framställde en vattenlösning av butansyra och märkte att den luktade illa. Hur skulle hen kunna minska lukten genom att justera lösningens pH? Motivera ditt svar. 3 p.
I svaret identifieras orsaken till lukten, alltså de oladdade butansyramolekylerna, eller att man måste minska mängden av de oladdade butansyramolekylerna.
(1 p.)
Eftersom butansyran är en syra förminskas den oladdade molekylens koncentration i vätskan om lösningen blir mer basisk.
ELLER
Studeranden kan alltså minska på lukten i laboratoriet genom att höja lösningens pH / genom att neutralisera lösningen.
(1 p.)
Basen neutraliserar syran. / Basen reagerar med syran. / I svaret beaktas butansyrans syraform och basform.
(1 p.)
Alternativt kan poängen ansamlas genom en förklaring av jämviktsreaktionen:
-
Butansyran är en svag syra. / Protolysen av butansyra är en jämviktsreaktion. (1 p.)
-
Man måste höja pH-värdet (1 p.),
-
och då förskjuts jämvikten mot produkterna (1 p.).
6.3 Vissa föreningar som framställts utgående från butansyra doftar gott och de används i parfymer och livsmedel. Till exempel har metylbutanat en fruktig doft som påminner om äpple. Namnge reaktionstypen med vilken man kan framställa metylbutanat utgående från butansyra. 2 p.
Förestringsreaktion (eller substitutionsreaktion eller kondensationsreaktion). (2 p.)
7. Galvanisk cell och elektrolyscell 15 p.
7.1
En studerande hade som uppgift att konstruera en galvanisk cell. Hen hade till sitt förfogande en vattenlösning av magnesiumklorid, en vattenlösning av koppar(II)klorid, en kopparskiva, en magnesiumskiva och annan nödvändig utrustning.
Komplettera meningarna genom att skriva ett lämpligt ord eller talvärde i luckorna.
7 p.
7.1.1 1 p.
magnesiumskivan / magnesium (1 p.)
7.1.2 1 p.
kopparskivan / koppar (1 p.)
7.1.3 1 p.
magnesium (1 p.)
-
anoden eller oädlare godkänns inte.
7.1.4 1 p.
kopparjoner (1 p.)
-
I det här fallet godkänns även koppar (med beaktande av uppgiftsformuleringen).
-
Kopparskivan, kopparkloriden, katoden godkänns inte.
7.1.5 1 p.
2,71 V ELLER 2,71 (1 p.)
7.1.6 1 p.
ledare (1 p.)
-
Olika synonymer till ledare godkänns.
-
Enbart en apparat godkänns inte, till exempel lampa, spänningsmätare, strömkrets.
7.1.7 1 p.
7.2
Härnäst ska vi betrakta en elektrolysapparatur som används för att utföra elektrolys på en smälta som innehåller magnesiumklorid och koppar(II)klorid. Vi antar att normalpotentialvärdena i smältan är desamma som i en vattenlösning.
Motivera vilket ämne som reduceras och vilket som oxideras först i den här elektrolysen.
3 p.
Ämnet som oxideras: kloridjonen oxideras (till klorgas) (eftersom de andra jonerna redan är i oxiderad form). (1 p.)
Ämnet som reduceras: kopparjonen reduceras först (1 p.).
Motivering:
Koppar har en högre reduktionspotential än magnesium
ELLER
Kloridjonen är det enda ämne som kan oxideras i den här elektrolysen.
(1 p.)
-
Ur svaret ska det framgå antingen med ord eller med kemiska symboler att det är fråga om kopparjonen och kloridjonen.
-
Poängen för motiveringen kan ansamlas bara om både ämnet som oxideras och ämnet som reduceras är rätt.
7.3 Förklara tre väsentliga skillnader mellan strukturen och funktionen för elektrolyscellen i deluppgift 7.2 och strukturen och funktionen för den galvaniska cellen i deluppgift 7.1. 5 p.
I svaret beskrivs skillnaderna i strukturen och funktionen mellan den galvaniska cellen och elektrolyscellen (1–2 p. för varje skillnad som beskrivs, sammanlagt högst 5 p.).
-
Poängsättning:
-
Den första skillnaden i strukturen, 2 p.
-
Den första skillnaden i funktionen, 2 p.
-
Den andra skillnaden i antingen strukturen eller funktionen, 1 p.
-
-
I jämförelsen ska man jämföra både den galvaniska cellen och elektrolyscellen. Beskrivningarna får inte stå i konflikt med uppgiftsformuleringen, det vill säga beskrivningarna måste vara i överensstämmelse med situationerna i deluppgifterna 7.1 och 7.2. Till exempel godkänns inte en beskrivning av elektrolys av en vattenlösning.
Skillnader i strukturen, till exempel:
-
Kärlet: I elektrolyscellen är båda elektroderna i samma kärl. I den galvaniska cellen är elektroderna i olika halvceller.
ELLER I den galvaniska cellen förenas elektrolyterna med en saltbrygga men i elektrolyscellen används inte en saltbrygga. -
Cellernas poler: I elektrolyscellen är anoden den positiva elektroden och katoden den negativa elektroden. I en galvanisk cell är anoden den negativa elektroden och katoden den positiva elektroden.
-
Sambandet mellan elektrisk energi och kemisk energi: En elektrolyscell behöver en spänningskälla. / En elektrolyscell konsumerar elenergi. En galvanisk cell är en spänningskälla. / En galvanisk cell producerar elenergi. / Till den galvaniska cellen kopplas en voltmätare/belastning.
-
I den galvaniska cellen är elektrolyterna vattenlösningar av salter. I elektrolyscellen är elektrolyten en saltsmälta.
-
I den galvaniska cellen är elektroderna av olika material. I elektrolyscellen kan elektroderna vara av samma material.
Skillnader i funktionen, till exempel:
-
Spontaniteten för reduktions-oxidationsreaktionen: I en elektrolyscell är reaktionen påtvingad. I en galvanisk cell är reaktionen spontan.
-
Elektroderna: I en elektrolyscell använder man oftast passiva/inerta elektroder som till exempel grafit eller platina. Elektroderna i en galvanisk cell kan antingen delta i reaktionen eller vara passiva. / Elektroderna i en galvanisk cell består av olika metaller.
-
Den galvaniska cellen producerar elenergi. Elektolyscellen konsumerar elenergi.
-
Oxidation och reduktion: I elektrolyscellen oxideras kloridjonerna till klorgas medan koppar- och/eller magnesiumjonerna reduceras till sin grundämnesform/till koppar/till magnesium. I en galvanisk cell oxideras magnesium/den oädlare metallen till katjoner och kopparjonerna/den ädlare metallens joner reduceras till grundämnesform/koppar.
ELLER
I elektrolyscellen oxideras anjonerna/de negativa jonerna till sin grundämnesform och katjonerna reduceras till sin grundämnesform. I den galvaniska cellen oxideras anoden, som ofta är i grundämnesform, till katjoner medan det ädlare ämnets katjoner reduceras till grundämnesform.
8. Bestämning av jämviktskonstanten 15 p.
En forskare ville bestämma värdet på jämviktskonstanten för reaktionen mellan järn(III)-jonen och tiocyanatjonen vid en viss temperatur. I reaktionen bildas den röda koordinationskomplexjonen [Fe(SCN)]²⁺, enligt följande reaktionsformel:
Fe³⁺(aq) + SCN⁻(aq) ⇌ [Fe(SCN)]²⁺(aq)
8.1 Forskaren utförde en spektrofotometrisk bestämning av lösningens [Fe(SCN)]²⁺-jonkoncentration. Absorptionsspektrumet för [Fe(SCN)]²⁺-lösningen vid våglängder för synligt ljus visas i bild . Vid vilken våglängd ska man avläsa absorbansen då man ska bestämma [Fe(SCN)]²⁺-jonkoncentrationen? Motivera ditt svar. 3 p.
Det lönar sig att avläsa absorbansen vid dess maximiställe (1 p.) vilket är ungefär vid våglängden 460 nm (1 p.). Då absorbansen avläses vid maximistället kommer skillnaden mellan de olika mätningarna att bli möjligast stor. På så vis blir bestämningens känslighet (noggrannhet) bättre och man kan analysera mindre halter. (1 p.)
-
De godkända värdena för våglängden är inom intervallet 450 nm–470 nm.
8.2
Forskaren framställde standardlösningar och uppmätte absorbansen för lösningarna vid den valda våglängden. Halterna och absorbanserna för standardlösningarna visas i tabell .
Sedan framställde forskaren en reaktionslösning genom att blanda samman en lösning som innehöll järn(III)joner och en lösning som innehöll tiocyanatjoner. Reaktionslösningens absorbans var 0,757 vid den valda våglängden.
Rita grafen för standardlinjen och beräkna koncentrationen för [Fe(SCN)]²⁺-jonen i reaktionslösningen.
6 p.
A = 4704,1 l/mol ⋅ c − 0,0005676
(4 p.)
Poängsättning av grafen och ekvationen:
-
Axlarna är ritade i rätt ordning, 1 p.
-
Axlarnas namn och enheter är rätt, 1 p.
-
Rätt mätpunkter är insatta i grafen och en rät linje har anpassats till mätpunkterna, 1 p.
-
Om anpassningen inte är lineär eller om ingen anpassning har gjorts kan högst 2 p. ansamlas för deluppgiften (om axlarna är rätt och namngivna rätt).
-
Om punkten (0,0) har utelämnats avdras 1 p.
-
-
Ekvationen är rätt, 1 p.
Vi bestämmer koncentrationen för det okända provet med hjälp av ekvationen:
c = (0,757 + 0,0005676) / (4704,1 l/mol) = 1,6105 ⋅ 10⁻⁴ mol/l = 1,61 ⋅ 10⁻⁴ mol/l
(2 p.)
-
Om koncentrationen har bestämts ur grafen med hjälp av ett räkneprogram förutsätts att avläsningen har gjorts vid en punkt, vars värde avrundas till 0,757.
8.3
Forskaren framställde en ny reaktionslösning i en 10 ml mätkolv genom att tillsätta 2,00 ml Fe(NO₃)₃-lösning med koncentrationen 5,00 ⋅ 10⁻³ mol/l och 3,00 ml KSCN-lösning med koncentrationen 3,00 ⋅ 10⁻³ mol/l i mätkolven som sedan fylldes med vatten till markeringen. Utifrån absorbansen var jämviktskoncentrationen av [Fe(SCN)]²⁺-joner i lösningen 8,12 ⋅ 10⁻⁵ mol/l.
Beräkna jämviktskoncentrationerna för de övriga jonerna som deltog i reaktionen samt värdet för reaktionens jämviktskonstant.
6 p.
Vi beräknar jonernas koncentrationer i början:
n(Fe³⁺) = 5,00 ⋅ 10⁻³ mol/l ⋅ 2,00 ⋅ 10⁻³ l = 1,00 ⋅10⁻⁵ mol
n(SCN⁻) = 3,00 ⋅ 10⁻³ mol/l ⋅ 3,00 ⋅ 10⁻³ l = 9,00 ⋅10⁻⁶ mol
(1 p.)
c(Fe³⁺) = 1,00 ⋅ 10⁻⁵ mol / (10,00 ⋅ 10⁻³ l) = 1,00 ⋅10⁻³ mol/l
c(SCN⁻) = 9,00 · 10⁻⁶ mol / (10,00 · 10⁻³ l) = 9,00 · 10⁻⁴ mol/l
(1 p.)
-
Uppgiften utgår från jonernas koncentrationer. Om enbart salternas koncentrationer har behandlats i svaret, 0 p. för deluppgiften. Kaliumjonerna och nitratjonerna deltar inte i reaktionen.
Vi betraktar jämviktssituationen:
| Fe³⁺(aq) | + | SCN⁻(aq) | ⇌ | [Fe(SCN)]²⁺(aq) | |
|
I början (mol/l) | 1,00 ⋅10⁻³ | 9,00 ⋅10⁻⁴ mol | 0 | ||
|
Förändring (mol/l) | −x | −x | +x | ||
| Vid jämvikt | 1,00 ⋅10⁻³ mol/l− x | 9,00 ⋅10⁻⁴ mol/l − x | x = 8,12 ⋅ 10⁻⁵ mol/l |
Jämviktskoncentrationerna:
c(Fe³⁺) = 1,00 ⋅10⁻³ mol/l−x = 1,00⋅10⁻³ mol/l −8,12⋅10⁻⁵ mol/l = 9,188 ⋅ 10⁻⁴ mol/l
c(SCN⁻) = 9,00 · 10⁻⁴ mol/l – x = 9,00 · 10⁻⁴ mol/l – 8,12 · 10⁻⁵ mol/l = 8,188 · 10⁻⁴ mol/l
(2 p.)
-
Om betraktelsen av jämvikten innehåller felaktigheter kan högs 3 p. ansamlats för uppgiften (koncentrationen i början och uttrycket för Kc.
-
Godkänns inte att behandla jämviktssituationen med substansmängder.
Beräkning av jämviktskonstantens värde:
K_c =\frac{c\left(\left[\mathrm{Fe(SCN)}\right]^{2+}\right)}{c\left(\mathrm{Fe}^{3+} \right) \cdot c\left(\mathrm{SCN}^- \right)}
(1 p.)
Kc = 8,12 ⋅ 10⁻⁵ / (9,188 ⋅ 10⁻⁴ ⋅ 8,188 ⋅ 10⁻⁴) = 107,93 ≈108
Svaret godkänns med enhet (108 l/mol) eller utan enhet.
(1 p.)
Del 3: 20-poängsuppgifter
9. Ferratjonen 20 p.
9.1
Vilket är oxidationstalet för järn i ferratjonen?
Krom kan också bilda joner med syre, där krom har samma oxidationstal som järn har i ferratjonen. Skriv formeln för en sådan jon som innehåller krom och syre och skriv också dess namn.
4 p.
Oxidationstalet för järn är +6 ELLER +VI.
(2 p.)
-
Om järnets oxidationstal är fel, 0 p. för deluppgiften.
Kromatjonen \mathrm{CrO}_4^{2-}
eller
dikromatjonen \mathrm{Cr_2O}_7^{2-}
(2 p.)
-
Rätt formel, 1 p.
-
Rätt formel namngiven rätt, 1 p.
9.2 Järnsyra är en tvåvärd syra. Då järnsyra reagerar med natriumhydroxid bildas natriumferrat och vatten. Skriv molekylformeln för järnsyra. 2 p.
H₂FeO₄
(2 p.)
-
Om vätet är skrivet i mitten av formeln eller om järnets och syrets ordningsföljd är omvänd, högst 1 p.
-
Svaret ska vara en molekylformel.
9.3 Ferratjonen reduceras i en sur vattenlösning till en Fe³⁺-jon. I reaktionen bildas också vatten. Skriv halvreaktionen som beskriver reduktionen av ferratjonen i sur omgivning. Du behöver inte skriva ut beteckningar för aggregationstillstånden. 3 p.
\mathrm{FeO_4^{2-} + 8H^{+} + 3e^{-}} \rightarrow \mathrm{Fe^{3+}+4H_2O}
(3 p.)
Poängsättning:
-
Alla utgångsämnen, produkter och elektroner rätt, 2 p.
-
Därtill alla koefficienter rätt, 1 p.
9.4 Man kan framställa en vattenlösning av natriumferrat genom att hetta upp fast järn(III)hydroxid i en vattenlösning som innehåller natriumhypoklorit (NaClO) och natriumhydroxid. Hypokloritjonen fungerar som oxidationsmedel i reaktionen och hypokloritjonen reduceras själv till en kloridjon. Skriv reaktionsformeln (reaktionslikheten) för framställning av natriumferrat. 7 p.
2Fe(OH)₃(s) + 3NaClO(aq) + 4NaOH(aq) → 2Na₂FeO₄(aq) + 5H₂O(l) + 3NaCl(aq)
(7 p.)
Poängsättning:
-
alla utgångsämnen rätt, 1 p.
-
Därtill alla produkter rätt, 3 p.
-
Därtill alla koefficienter rätt, 2 p. och alla aggregationstillstånd rätt, 1 p.
-
Reaktionen kan skrivas i jonform, men det förutsätts att den kan balanseras rätt, även med avseende på laddningarna. Till exempel: om ämnena i övrigt är skrivna som neutrala föreningar men produktsidan innehåller kloridjoner skilt för sig, erhålls högst 1 p. för deluppgiften, om utgångsämnena är rätt.
9.5 Ferratjonens reduktionspotential är +2,20 V i sur omgivning. I basisk omgivning är reduktionspotentialen +0,72 V. Motivera varför det lönar sig att justera pH-värdet för en vattenlösning av ferratjoner till basiskt innan lösningen lagras. 4 p.
Vattnets oxidationsreaktion har potentialvärdet −1,23 V.
ELLER
2H₂O(l) → O₂(g) + 4H⁺ (aq) + 4e⁻ , E = −1,23 V.
(1 p.)
I sura förhållanden är summan av ferratjonens reduktionspotential och vattnets oxidationspotential positiv.
ELLER
E = +2,20 V + (−1,23 V) = 0,97 V > 0 V
(1 p)
I basiska förhållanden är däremot summan av ferratjonens reduktionspotential och vattnets oxidationspotential negativ.
ELLER
E = +0,72 V + (−1,23 V) = −0,51 V < 0 V
(1 p)
-
Om potentialens enhet (V) inte alls skrivits ut i svaret, −1 p.
Slutsats:
I sura förhållanden börjar ferratjonen oxidera vatten och ferratjonen reduceras själv till en Fe³⁺-jon.
ELLER
I sura förhållanden reducerar vattnet ferratjonen till en Fe³⁺-jon.
ELLER
I basiska förhållanden sker inte reduktionen av ferratjonen spontant.
(1 p.)
-
Poängen för slutsatsen kan erhållas bara om minst ett av de tidigare poängen har erhållits.
Ett alternativt, bristfälligt svar, i vilket halvreaktionernas normalpotentialvärden inte alls använts, ger högst 1 p. för deluppgiften. Till exempel:
I sura förhållanden är ferratjonens reduktionspotential större än i basiska förhållanden så ferratjonen reduceras lättare i sura förhållanden.
10. Att avlägsna kolmonoxid 20 p.
10.1 Ge ett exempel på en situation eller en process där det bildas kolmonoxid. Berätta hurdana reaktionsförhållanden som hör ihop med bildandet av kolmonoxid. 2 p.
Kolmonoxid bildas i samband med ofullständig förbränning.
(1 p.)
-
Som svar godkänns inte att syre är den begränsande faktorn eller att förbränningen sker i syrefria förhållanden.
Kolmonoxid bildas till exempel i förbränningsmotorer, i industriella förbränningsprocesser, av trä som inte bränns på rätt sätt, vid eldsvådor och vid tobaksrökning.
-
Det räcker att ge ett exempel.
10.2 Varför är det farligt om kolmonoxid ansamlas i inomhusluften? 3 p.
1 p. per observation:
-
Kolmonoxid är en giftig gas.
-
Kolmonoxiden binder till hemoglobinet / blodet i stället för syre. Det här leder till osförgiftning.
-
Tillsammans med luft bildar kolmonoxid en gasblandning som antänds mycket lätt.
-
Människan kan inte förnimma kolmonoxid.
-
Kolmonoxiden tränger undan rumsluften om halten av kolmonoxid är mycket hög. (Det här är en osannolik situation som förutsätter mycket höga kolmonoxidmängder.)
10.3 Vilka skadliga effekter och farliga egenskaper har koldioxid, alltså CO₂? 2 p.
1 p. / skadlig effekt eller farlig egenskap. Till exempel:
-
I höga halter är koldioxid en kvävande gas.
-
I något förhöjda halter ger koldioxid upphov till exempelvis huvudvärk och trötthet.
-
Koldioxid är en växthusgas som ger upphov till uppvärmning av klimatet.
-
Koldioxid orsakar försurning av vattendrag.
Svar som är för ospecifika godkänns inte, till exempel:
-
Koldioxid är skadligt för hälsan / atmosfären / vattendrag.
-
Koldioxiden tränger undan syret i blodomloppet.
För svar som är klart felaktiga kan 1 p. avdras, till exempel:
-
Koldioxid bryter ned ozonskiktet.
-
Koldioxid är lättantändligt / explosivt.
10.4
Man utforskade en ny katalysator för oxidationsreaktionen för kolmonoxid. Kolmonoxid och syre inneslöts i ett tryckkärl vid rumstemperatur. Trycket i kärlet var 102 kPa. Med hjälp av en katalysator reagerade kolmonoxiden fullständigt till koldioxid vid en förhöjd temperatur:
2CO(g) + O₂(g) → 2CO₂(g)
Då reaktionskärlet hade svalnat tillbaka till rumstemperatur var trycket i kärlet 85 kPa. Hur många volymprocent koldioxid fanns det i blandningen efter reaktionen?
13 p.
Det finns många olika sätt att lösa uppgiften. Nedan beskrivs ett sätt. I alla olika svarssätt ansamlas poängen (13 p.) enligt följande principer:
-
Substansmängderna för kolmonoxid, syre och koldioxid i början och slutet har presenterats på ett korrekt sätt (till exempel med hjälp av en jämviktstabell), 3 p.
-
Om den här uppställningen är felaktig kan högst 5 oberoende poäng erhållas för deluppgiften.
-
-
Den sammanlagda substansmängden för gasblandningen både i början och i slutet, 2 p.
-
De oberoende poängen, sammanlagt 5 p., betecknas med ip i beskrivningen nedan. Om något principfel har gjorts i svaret kan ändå de här poängen ansamlas.
-
Resten av beräkningen och rätt svar, sammanlagt 3 p.
p(början) = 102 kPa
p(slutet) = 85 kPa
nₜₒₜ = totala substansmängden gaser före reaktionen
| 2CO(g) | + | O₂(g) | → | 2CO₂(g) | |
| I början (n/mol) | x | nₜₒₜ − x | 0 | ||
| I slutet (n/mol) | 0 | ( n ₜₒₜ − x ) − x/2 | x |
(3 p.)
Ur tabellen får vi den totala substansmängden i början (CO och O₂) och i slutet (O₂ och CO₂):
n(början) = nₜₒₜ
n(i slutet) = (nₜₒₜ − x) − x/2 + x = nₜₒₜ − x/2
(2 p.)
Ur svaret framgår att det finns syre i överskott i reaktionskärlet.
(1 ip.)
Under reaktionen är volymen och temperaturen konstanta, det vill säga trycken uppmättes för samma volym och vid samma temperatur.
(1 ip.)
Utifrån formeln pV = nRT är trycket direkt proportionellt mot substansmängden.
(1 ip.)
-
Enbart formeln räcker inte till för poäng.
Vi förkortar bort T, V och R som är konstanta:
p(början) · V = n(början) · RT
p(slutet) · V = n(slutet) · RT
Vi dividerar ekvationerna ledvis.
Vi får: p(början) / p(slutet) = n(början) / n(slutet)
(2 ip.)
102 kPa / 85 kPa = nₜₒₜ / (nₜₒₜ – x/2)
Vi får:
x = 1/3 · nₜₒₜ
Gasens volym är direkt proportionell mot substansmängden. Efter reaktionen är volymprocenten för CO₂:
Vol.-%(CO₂) = V(CO₂) / V(CO₂+O₂) = [n(CO₂)RT / p] / [n(CO₂+O₂)RT / p] = n(CO₂) / n(CO₂+O₂)
Vol.-%(CO₂) = x / (nₜₒₜ − x/2)
Vi sätter in det här i formeln x = 1/3 · nₜₒₜ
Vol.-%(CO₂) = (1/3 · nₜₒₜ) / (nₜₒₜ – 1/3 · nₜₒₜ / 2)
= 40 %
(3 p.)
11. Vätebaserad ekonomi 20 p.
11.1 Man kan lagra och transportera väte som en gas under högt tryck. Varför skulle det vara farligt om vätgasen skulle läcka ut? 2 p.
1 p. / observation:
-
Väte är en lättantändlig gas.
-
Väte reagerar med luft/syre.
-
En explosion eller eldsvåda kan uppstå (den här poängen förutsätter att vätets lättantändlighet eller reaktion med luft/syre har beskrivits).
-
Förbränningen av väte är en exoterm reaktion. Då väte brinner frigörs heta gaser.
-
Om det ansamlas en stor mängd väte i ett slutet utrymme finns risk för kvävning.
-
Väte är svårt att förnimma för det är färglöst/luktlöst/smaklöst.
11.2 Ett annat sätt att lagra och transportera väte är som en vätska vid normaltryck. Förklara med hjälp av vätets struktur varför väte vid normalt lufttryck förblir i vätskeform enbart om temperaturen är mycket låg. 3 p.
Högst 3 p. ansamlas av följande:
Vätemolekylen är opolär (1 p.). Därför bildas det bara dispersionskrafter mellan vätemolekylerna (1 p.). Eftersom vätemolekylen är mycket liten är dispersionskrafterna särskilt svaga (1 p.).
Enbart vid mycket låga temperaturer är molekylernas kinetiska energi så låg att den inte räcker till för att kompensera för dispersionskrafterna mellan molekylerna. (1 p.)
-
Om någon annan växelverkan än dispersionskrafter beskrivs mellan vätemolekylerna, eller om svaret innehåller en beskrivning av att molekylens inre bindningar brister, 0 p. för deluppgiften.
11.3 Det är möjligt att väte kan komma att användas som trafikbränsle i framtiden. Vilka är fördelarna och utmaningarna med att använda väte som energikälla för bilar? Du kan utnyttja text i ditt svar. 5 p.
I svaret beskrivs både fördelar och utmaningar som hör ihop med användningen av väte som bränsle i bilar. Sammanlagt högst 5 p.
Fördelar, 1 p. / fördel, högst 3 p. Till exempel:
-
Det finns mycket vatten tillgängligt (som är utgångsämne för vätet i elektrolysen).
-
Produktionen av väte orsakar bara lite koldioxidutsläpp om elen som behövs för elektrolysen är producerad med icke-fossila energikällor.
-
Då väte används som bränsle / i en bränslecell bildas det inte koldioxidutsläpp utan den enda produkten är vatten.
-
Det är snabbare att tanka väte än att ladda en elbil. ELLER I en bränslecell producerar man elektricitet utgående från väte. Bilen är därmed nästan ljudlös och det här minskar bullret från trafiken jämfört med bilar med förbränningsmotor.
-
Väte har ett högt energiinnehåll per massenhet.
-
Bränslecellen har en hög verksamhetsgrad.
Utmaningar, högst 3 p. Till exempel:
-
Väte finns inte i fri form i naturen.
-
Framställningen av väte kräver katalysatorer / kritiska grundämnen, vilka är sällsynta eller dyra. ELLER Framställningen av väte producerar koldioxidutsläpp om man använder fossila energikällor.
-
Olika utmaningar som hör ihop med lagring eller överföring av väte. Till exempel: överföringen av vätet som en gas på ett effektivt sätt förutsätter att trycket i gasledningen är högt så att det ska rymmas en betydande mängd väte i en skälig volym. ELLER Överföringen av väte som vätska kräver en mycket låg temperatur. ELLER Lagring av väte kräver höga tryck eller mycket låga temperaturer. Det här förbrukar mycket energi och är tekniskt utmanande. ELLER Det finns ännu inte något distributionsnätverk så man skulle vara tvungen att bygga det.
-
Väte har ett lågt energiinnehåll per volymenhet.
11.4 Förklara hur man kan använda väte i energiproduktionen. På vilket sätt skulle användningen av väte minska koldioxidutsläppen? Använd dina kunskaper i kemi samt text i ditt svar. 6 p.
Användningen av väte i energiproduktionen, högst 5 p.:
Då det produceras mer elektricitet än vad det förbrukas kunde överskottsenergin utnyttjas som energikälla till elektrolys av vatten för att producera väte (1 p.). På det här sättet kan man producera väte med förnybar energi (1 p.). Väte kan användas som energikälla genom att direkt förbränna det (1 p.) eller till exempel i bränsleceller (1 p.). Utgående från väte kan man också producera andra ämnen som till exempel kolväten och metanol och de här kan användas som bränslen. (1 p.)
Att minska koldioxidutsläppen, högst 2 p.:
-
Användningen av väte inverkar direkt så att det inte bildas koldioxidutsläpp. Till exempel: Då man förbränner väte bildas det bara vatten och det bildas inga koldioxidutsläpp (1 p.).
-
Användningen av väte inverkar indirekt så att det inte bildas koldioxidutsläpp. Till exempel: Energin som producerats med hjälp av väte kan användas för att ersätta energi som producerats med fossila bränslen (1 p.).
11.5 Läs text . Varför är det mer energieffektivt att med Fischer–Tropsch-processen producera kolväten genom att använda kolmonoxid som utgångsämne i stället för koldioxid? Hur stor är reaktionsentalpin per mol koldioxid då man använder koldioxid som utgångsämne? 4 p.
Omvandlandet av koldioxid till kolmonoxid är en endoterm process.
(1 p.)
Helhetsprocessen kräver mer energi om man använder koldioxid som utgångsämne.
(1 p.)
Reaktionsentalpin för totalreaktionen skulle vara
+41 kJ/mol + (−152 kJ/mol) = −111 kJ/mol.
(2 p.)