Hyvän vastauksen piirteet: FI – Kemia
23.9.2025
Lopulliset hyvän vastauksen piirteet 13.11.2025
18.11.2025 klo 13.30 lisätty vastauksen oikea pyöristys osatehtävässä 9.3.
Lopullisista hyvän vastauksen piirteistä ilmenevät perusteet, joiden mukaan koesuorituksen lopullinen arvostelu on suoritettu. Tieto siitä, miten arvosteluperusteita on sovellettu kokelaan koesuoritukseen, muodostuu kokelaan koesuorituksestaan saamista pisteistä, lopullisista hyvän vastauksen piirteistä ja lautakunnan määräyksissä ja ohjeissa annetuista arvostelua koskevista määräyksistä. Lopulliset hyvän vastauksen piirteet eivät välttämättä sisällä ja kuvaa tehtävien kaikkia hyväksyttyjä vastausvaihtoehtoja tai hyväksytyn vastauksen kaikkia hyväksyttyjä yksityiskohtia. Koesuorituksessa mahdollisesti olevat arvostelumerkinnät katsotaan muistiinpanoluonteisiksi, eivätkä ne tai niiden puuttuminen näin ollen suoraan kerro arvosteluperusteiden soveltamisesta koesuoritukseen.
Ylioppilastutkinnon kokeessa selvitetään, ovatko opiskelijat omaksuneet lukion opetussuunnitelman mukaiset tiedot ja taidot sekä saavuttaneet lukiokoulutuksen tavoitteiden mukaisen riittävän kypsyyden. Kemian kokeessa arvioinnin kohteina ovat kemiallisen tiedon ymmärtäminen ja soveltaminen. Arvioinnissa otetaan huomioon myös kokeellisen tiedonhankinnan ja ‐käsittelyn taidot. Näihin kuuluvat esimerkiksi kokeiden suunnittelu, työvälineiden ja reagenssien turvallinen käyttö, tulosten esittäminen ja tulkitseminen sekä johtopäätösten tekeminen ja soveltaminen.
Kemian tehtäviä arvosteltaessa painotetaan oppiaineen luonteen mukaista esitystapaa sekä käsitteiden ja kielenkäytön täsmällisyyttä. Reaktioyhtälöt esitetään ilman hapetuslukuja pienimmin mahdollisin kokonaislukukertoimin ja olomuodoilla varustettuna. Orgaanisissa reaktioyhtälöissä käytetään rakennekaavoja, mutta olomuotoja ei tarvitse mainita. Rakennekaavojen eri esitystavat hyväksytään.
Laskennallisissa tehtävissä suureyhtälöjä ja kaavoja käytetään tavalla, joka osoittaa kokelaan ymmärtäneen tehtävänannon oikein ja soveltaneen ratkaisussaan asianmukaista periaatetta tai lakia. Vastauksesta ilmenee yksiselitteisesti, miten lopputulokseen päädytään, mutta laajoja välivaiheita ei tarvita. CAS-ohjelmia voi hyödyntää tehtävän eri vaiheissa. Merkintätapojen kannalta keskeisiä vaiheita ovat periaatteiden ja lakien sekä lopputuloksen ja johtopäätösten esittäminen. Lopputulokset annetaan lähtöarvojen mukaisella tarkkuudella yksiköineen ja johtopäätökset perustellaan.
Mittaustuloksia ja niistä piirrettyjä kuvaajia hyödynnetään tiedon analysoinnissa ja johtopäätösten tekemisessä. Mittauspisteisiin sovitetaan asianmukainen suora. Mittauspisteiden välisiä arvoja voi interpoloida kuvaajaa silmämääräisesti lukemalla tai sopivalla ohjelmalla. Kuvaajaan merkitään akselien nimet, yksiköt ja asteikko. Kuvaajaan merkitään johtopäätösten kannalta olennaiset kohdat, kuten titrauskäyrän ekvivalenttikohta tai hetkellistä nopeutta laskettaessa kyseinen tangentti.
Essee‐ ja selittävissä vastauksissa tekstiä täydennetään reaktioyhtälöillä, kaavoilla tai piirroksilla. Käsiteltäviä ilmiöitä kuvataan makroskooppisella, mikroskooppisella ja symbolisella tasolla. Vastauksesta ilmenee, että tehtävään liittyvää aineistoa on hyödynnetty, sovellettu, analysoitu ja arvioitu tehtävänannon mukaisesti. Hyvä vastaus on jäsennelty ja sisällöltään johdonmukainen.
Vastaus arvostellaan tehtäväkohtaisten kriteerien mukaisesti. Lähtökohtana ovat vastauksen ansiot, joista kertyy pisteitä. Jos keskeinen kemiallinen periaate puuttuu tai se on virheellinen, pisteiden kertyminen päättyy. Tällöin virheellisen tuloksen siirtymistä eteenpäin ei hyväksytä (ei-VSE). Tällaiset virheet ovat esimerkiksi stoikiometriavirheet, väärä rajoittava tekijä tai väärä aine reaktioyhtälössä. Muiden puutteiden tai virheiden tapauksessa virheellisen tuloksen siirtyminen eteenpäin hyväksytään (VSE), jolloin pisteiden kertyminen jatkuu puutteen tai virheen jälkeen. Kokeen osan 3 vaativat tehtävät edellyttävät täsmällisempää periaatteiden hallintaa kuin kokeen alkupään perustehtävät. Kemian kannalta epätäsmällisestä kielenkäytöstä, pienestä laskuvirheestä tai likiarvojen huolimattomasta käytöstä vähennetään 0–3 p. esimerkiksi seuraavasti:
- pyöristys- ja kopiointivirheet, jotka eivät vaikuta lopputulokseen, −0 p.
- kopiontivirheet, pyöristysvirheet ja pienet huolimattomuusvirheet, jotka vaikuttavat lopputulokseen, yksittäinen pieni virhe rakennekaavassa −1 p.
- yksikönmuunnosvirheet, systemaattinen virhe rakennekaavassa tai muut vähäistä suuremmat virheet, jossa ei kuitenkaan ole väärä kemiallinen periaate −2 p.
Osa 1: 20 pisteen tehtävä
1. Monivalintatehtäviä kemian eri osa-alueilta 20 p.
1.1 Mikä seuraavista tekniikoista on kemiallinen erotusmenetelmä? 2 p.
- uuttaminen (2 p.)
1.2 Millä seuraavista vesiliuoksista on alhaisin pH? Jokaisen liuoksen konsentraatio on sama. 2 p.
- HCl(aq) (2 p.)
1.3 Mikä seuraavista yhdisteistä liukenee huonoimmin veteen? 2 p.
- heptan-1-oli (2 p.)
1.4 Mikä seuraavista aineista on neste 25 °C:n lämpötilassa ja 100 kPa:n paineessa? 2 p.
- propan-1-oli (2 p.)
1.5 Sykloheksaanin tuoli- ja venemuoto ovat toistensa 2 p.
- konformaatioisomeerejä. (2 p.)
1.6 Mitä seuraavista alkuaineista löytyy eniten maankuoresta? 2 p.
- alumiini (2 p.)
1.7 Kuvassa on esitetty tasapainoreaktion A ⇌ B eteneminen ajan funktiona. Millä aikavälillä etenevä reaktio on nopeimmillaan? 2 p.
- aikavälillä 0–30 sekuntia (2 p.)
1.8 Mikä seuraavista yhdisteistä voi hapettua niin, että muodostuu aldehydi? 2 p.
- propan-1-oli (2 p.)
1.9 Minkä alla olevan yhdisteen ¹H-NMR-spektrissä on vähiten piikkejä? 2 p.
- propan-2-oni (2 p.)
1.10
Ammoniakkia voidaan muodostaa suljetussa astiassa reaktiolla
N₂(g) + 3H₂(g) ⇌ 2NH₃(g).
Mitä tapahtuu, jos astiaan lisätään heliumia? Oletetaan, että kaikki kaasut käyttäytyvät ideaalikaasun tavoin.
2 p.- Ammoniakkia muodostuu yhtä paljon kuin ennen heliumin lisäämistä. (2 p.)
Osa 2: 15 pisteen tehtävät
2. Kalsiumnitridi 15 p.
Kun kuuma kalsiummetalli reagoi typpikaasun kanssa, muodostuu kiinteää kalsiumnitridiä, Ca₃N₂.
Reaktioyhtälö on
3Ca(s) + N₂(g) → Ca₃N₂(s).
2.1 Kalsiumnäyte, jonka massa on 1,2500 g, reagoi täydellisesti typpikaasun kanssa. Typpikaasun lämpötila on 25,0 °C ja paine 103,5 kPa. Mikä on tarvittavan typpikaasun tilavuus? Anna vastaus millilitroina. 9 p.
n(Ca) = m(Ca)/M(Ca) = 1,2500 g / (40,08 g/mol) = 0,0311876 mol
(2 p.)
n(N₂) = 1/3 · n(Ca)
(2 p.)
-
Mikäli stoikiometriassa on virhe, 0 p. ja lopusta osatehtävästä ei voi ansaita pisteitä.
n(N₂) = 1/3 · 0,0311876 mol = 0,0103959 mol
(1 p.)
pV = nRT, josta ratkaistaan tilavuus V.
V(N₂) = n(N₂)RT/p
V(N₂) = [0,0103959 mol · 8,31446 Pa · m³ /(mol · K) · 298,15 K] / 103 500 Pa
(1 p.)
-
Mikäli lämpötila on sijoitettu yhtälöön celsiusasteina, 0 p. ja lopusta osatehtävästä ei voi ansaita pisteitä.
V(N₂) = 2,48995 · 10⁻⁴ m³
(1 p.)
Annetaan vastauksena tilavuus millilitroina tehtävänannon mukaisesti:
V(N₂) = 2,48995 · 10⁻⁴ m³ · 1 000 000 ml/m³= 248,995 ml ≈ 249,0 ml
(2 p.)
2.2 Mikä sidos on kalsiumnitridissä kalsiumin ja typen välillä? Perustele vastauksesi. 3 p.
Kyseessä on ionisidos (1 p.),
koska reaktiossa muodostuvat Ca²⁺- ja N³⁻-ionit. Nämä muodostavat ionihilan.
TAI
koska elektronegatiivisuusarvojen ero kalsiumin ja typen välillä on 2,0.
TAI
koska kalsium on metalli ja typpi epämetalli.
TAI
koska kalsium on luovuttanut elektroneja typelle/typpi on vastaanottanut elektroneja kalsiumilta.
(2 p.)
-
Jos nitridi-ionin sijasta puhutaan typpi-ionista, enintään 1 p.
2.3 Kalsiumnitridi reagoi herkästi nestemäisen veden kanssa. Reaktiossa muodostuu kalsiumhydroksidia ja ammoniakkia. Kirjoita tämän reaktion reaktioyhtälö. 3 p.
Ca₃N₂(s) + 6H₂O(l) → 3Ca(OH)₂(s/aq) + 2NH₃(g/aq)
-
Kaikki aineet oikein 1 p.
-
Oikeiden aineiden lisäksi kaikki kertoimet oikein 1 p. ja kaikki olomuodot oikein 1 p.
3. Elintarvikkeiden kemiaa 15 p.
3.1 Vastaa kirjoittamalla aukkoon oikea erotusmenetelmä. 3 p.
3.1.1 1 p.
- uutto (1 p.)
- uuttaminen (1 p.)
3.1.2 1 p.
- suodatusta (1 p.)
- suodattamista (1 p.)
3.1.3 1 p.
- kromatografia (1 p.)
- erilaiset todelliset kromatografiamenetelmät (1 p.)
3.2 Täydennä seuraavat virkkeet puuttuvilla sanoilla. Kuhunkin kohtaan tulee korkeintaan kaksi sanaa. 3 p.
3.2.1 1 p.
- homogeeninen (1 p.)
- tasakoosteinen (1 p.)
- liuos (1 p.)
3.2.2 1 p.
- emulsion (1 p.)
- heterogeenisen seoksen (1 p.)
- kaksi faasia (1 p.)
- eri faaseja (1 p.)
3.2.3 1 p.
- kaksi faasia (1 p.)
- faasiraja (1 p.)
- erilliset faasit (1 p.)
3.3 Täydennä seuraavat virkkeet puuttuvilla sanoilla. Kuhunkin kohtaan tulee korkeintaan kaksi sanaa. 3 p.
3.3.1 1 p.
- proteiini (1 p.)
- valkuaisaine (1 p.)
3.3.2 1 p.
- denaturoitumiseksi (1 p.)
- koaguloitumiseksi (1 p.)
3.3.3 1 p.
- aminohappoja (1 p.)
3.4 Täydennä seuraavat virkkeet puuttuvilla sanoilla. Kuhunkin kohtaan tulee korkeintaan kaksi sanaa. 3 p.
3.4.1 1 p.
- glykosidisidos (1 p.)
- eetterisidos (1 p.)
3.4.2 1 p.
- katalyytti (1 p.)
- entsyymi (1 p.)
3.4.3 1 p.
- hydrolyysireaktio (1 p.)
3.5 Täydennä seuraavat virkkeet puuttuvilla sanoilla. Kuhunkin kohtaan tulee korkeintaan kaksi sanaa. 3 p.
3.5.1 1 p.
- liuos (1 p.)
- homogeeninen seos (1 p.)
- tasakoosteinen seos (1 p.)
3.5.2 1 p.
- nestettä (1 p.)
- liuosta (1 p.)
- vettä (1 p.)
3.5.3 1 p.
- kaasua (1 p.)
- ilmaa (1 p.)
Myös muut oikeat ilmaisut hyväksytään.
-
Pienet kirjoitusvirheet hyväksytään, mutta vastauksen pitää olla yksiselitteinen.
4. Hyttysten houkutin okt-1-en-3-oli 15 p.
Ihmisen hiki sisältää okt-1-en-3-olia, jonka toinen enantiomeeri vetää puoleensa hyttysiä. Samaa yhdistettä käytetään myös hyttysansoissa.
Voit hyödyntää tiedostoa osatehtävien vastauksissa.
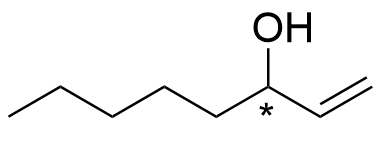
4.1 Merkitse okt-1-en-3-olin rakennekaavaan asymmetriakeskus eli kiraliakeskus. 1 p.
4.2 Piirrä okt-1-en-3-olin molemmat enantiomeerit (eli peilikuvaisomeerit eli optiset isomeerit). 4 p.
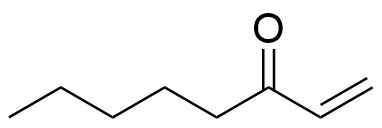
4.3 Ihon tuoksuun vaikuttaa yhdiste, joka on lähtöaine okt-1-en-3-olin valmistuksessa. Kun tämän lähtöaineen yksi funktionaalinen ryhmä pelkistetään, syntyy okt-1-en-3-olin hydroksiryhmä. Piirrä lähtöaineen rakennekaava ja nimeä lähtöaineen reagoiva funktionaalinen ryhmä. 4 p.
4.4 Mikä okt-1-en-3-olin osa on poolinen ja mikä pooliton? Okt-1-en-3-oli liukenee hyvin heksaaniin. Mitä heikkoja sidoksia okt-1-en-3-oli muodostaa heksaanin kanssa? Minkä molekyylien osien välille näitä heikkoja sidoksia muodostuu? 4 p.
Okt-1-en-3-olissa on poolinen hydroksiryhmä (1 p.) ja pooliton hiilivetyketju (1 p.). Okt-1-en-3-oli muodostaa heksaanin kanssa dispersiovoimia (1 p.).
Dispersiovoimia syntyy etenkin heksaanin ja okt-1-en-3-olin poolittomien hiilivetyrunkojen välille.
TAI
Dispersiovoimia esiintyy kaikkien molekyylien osien välillä. (1 p.)
-
Jos muita sidoksia kuin dispersiovoimia on kuvattu molekyylien väliin, kertyvät ainoastaan pisteet poolisen ja poolittoman osan tunnistamisesta (korkeintaan 2 p.).
4.5 Miksi okt-1-en-3-oli liukenee heikosti veteen? 2 p.
Vesi liuottaa hyvin poolisia aineita mutta huonosti poolittomia aineita.
TAI
Okt-1-en-3-oli on pääosin pooliton.
(1 p.)
Vain okt-1-en-3-olin hydroksiryhmä pystyy muodostamaan vetysidoksia vesimolekyylien kanssa.
(1 p.)
-
Vetysidos pitää kohdistaa hydroksiryhmän ja vesimolekyylin välille.
5. Raudan ruostuminen 15 p.
Raudan ruostuminen on esimerkki metallien korroosiosta. Ruostumisen ensimmäistä vaihetta voidaan kuvata seuraavien reaktioyhtälöiden avulla:
(1)\ \ \ \mathrm{Fe(s)}\ \rightarrow \ \mathrm{Fe^{2+}(aq)+2e^-}
(2)\ \ \ \mathrm{O_2(g)+2H_2O(l)+4e^-}\ \rightarrow \ \mathrm{4OH^-(aq)}
5.1 Onko raudan ruostuminen spontaani reaktio? Perustele vastauksesi. Hyödynnä vastauksessasi osareaktioiden (1) ja (2) normaalipotentiaaleja. 5 p.
Osareaktioiden normaalipotentiaalit:
(1)\ \ \ \mathrm{Fe(s)}\rightarrow\mathrm{Fe^{2+}(aq)+2e^-}\ \ \ E°=+0{,}45\ \mathrm{V}
(2)\ \ \ \mathrm{O_2(g)+2H_2O(l)+4e^-}\ \rightarrow\ \mathrm{4OH^-(aq)}\ \ \ E°=+0{,}40\ \mathrm{V}
(2 p.)
-
Reakioyhtälöitä ei vaadita.
Hapetus-pelkistysreaktion kokonaispotentiaali on 0,45 V + 0,40 V = +0,85 V.
(1 p.)
Koska kokonaispotentiaali on positiivinen,
(1 p.)
raudan ruostuminen on spontaani reaktio.
(1 p.)
5.2 Kuvaile yksi keino, jonka avulla rautaesineen ruostumista voidaan estää tai hidastaa. Perustele kuvailemasi keino kemiallisesti. 4 p.
Vastauksessa on mainittu yksi keino (2 p.) sekä keinon perustelu (2 p.) (puutteellisesta perustelusta kuitenkin korkeintaan 1 p.). Esimerkiksi:
-
Keino: Pinnoittaminen esimerkiksi muovilla, maalilla tai öljyllä
Perustelu: Metallin pinta ei pääse kosketuksiin hapettavien aineiden kanssa. -
Keino: Pinnoittaminen epäjalommalla metallilla, kuten galvanointi eli sinkillä pinnoittaminen
Perustelu: Sinkki on epäjalompi metalli kuin rauta. Sinkki myös hapettuu rautaa herkemmin. Galvanoinnissa muodostuva sinkkioksidikerros suojaa rautaa hapettumiselta. -
Keino: Uhrianodien eli uhrimetallien kiinnittäminen rautaan
Perustelu: Uhrianodi on rautaa epäjalompi metalli. Epäjalompi metalli hapettuu jalomman raudan sijaan. -
Keino: Raudan pitäminen kuivana tai rakenteiden suunnittelu niin, että vesi ei jää seisomaan rakenteisiin
Perustelu: Kosteus nopeuttaa ruostumista. Happi reagoi raudan kanssa nopeammin veteen liuenneena kuin ilmassa olevana kaasuna. Vesi toimii elektrolyyttiliuoksena, jossa ionit pääsevät liikkumaan. -
Keino: Pintojen hiominen tasaisiksi
Perustelu: Reagoiva pinta-ala on pienempi kuin rosoisessa metallissa. (Lisäksi kosteutta jää helpommin rosoiseen kuin sileään pintaan.) -
Keino: Pinnoitus metallilla, joka muodostaa passiivisen/tiiviin oksidikerroksen (kuten Al, Cr tai Zn).
Perustelu: Pinnoitteen muodostama tiivis oksidikerros ei päästä hapettavia aineita kosketuksiin raudan kanssa. -
Keino: Pinnoittaminen jalommalla metallilla.
Perustelu: Jalompi metalli ei hapetu yhtä helposti kuin rauta, ja voi siten suojata rautaa hapettavilta aineilta. -
Keino: Happamien vesiliuosten välttäminen.
Perustelu: Happamat liuokset sisältävät runsaasti vetyioneja, jotka edistävät metallin ruostumista. -
Keino: Suolaisten vesiliuosten välttäminen.
Perustelu: Liuenneet suolat lisäävät veden sähkönjohtavuutta, jolloin vesi toimii tehokkaammin elektrolyyttiliuoksena ja siten edistää ruostumista.
5.3
Suunnittele tutkimus, jossa selvitetään yhden raudan ruostumista estävän tai hidastavan keinon vaikutusta. Tutkimuksen pitää olla toteutettavissa koululaboratorion välineillä.
Kuvaile, kuinka koe suoritetaan, mikä tekijä kokeessa muutetaan, mitkä tekijät pidetään vakiona ja mitä havaintoja kokeessa tehdään.
6 p.
Tutkittava keino estää tai hidastaa ruostumista on kemiallisesti mielekäs. Koejärjestelyn kuvauksesta selviävät kokeen toteutustapa ja kokeessa tehtävät havainnot (3 p.) sekä kokeessa muuttuva tekijä ja kokeessa vakiona pidettävät tekijät (3 p.).
Esimerkiksi:
Kokeessa tutkitaan kahta samanlaista rautanaulaa. Toinen maalataan, toista ei käsitellä. Naulat laitetaan samanlaisiin astioihin, joissa on yhtä paljon yhtä väkevää suolaliuosta, ja niitä säilytetään samanlaisissa olosuhteissa valittu aika. Tämän jälkeen rautanaulojen ruosteen määrää vertaillaan toisiinsa visuaalisesti tai punnitsemalla.
Esimerkin pisteitys:
-
Tutkittava keino suojata metallia (maalaus) on järkevä. (1 p.)
-
Kokeessa muuttuva tekijä: Toinen koe-esine maalataan, toista ei. (1 p.)
-
Kokeen toteutustapa: Kokeen suoritus on kuvattu selkeästi. (1 p.)
-
Jos kokeen toteutustavalla ei voi todeta suojaustavan vaikutusta, 0 p. ja lopusta osatehtävästä ei voi ansaita pisteitä.
-
-
Kokeessa vakiona pidettävät tekijät: Kokeessa käytetyt tarvikkeet, kuten naulat, astiat ja suolaliuokset ovat samanlaiset. (1 p.)
-
Kokeen olosuhteet ovat samat TAI aika on samanlainen. (1 p.)
-
Kokeessa tehtävät havainnot: Vertaillaan ruosteen määrää koe-esineissä visuaalisesti tai punnitsemalla. (1 p.)
6. Metaani rakettipolttoaineena 15 p.
6.1 Nestemäinen metaani säilytetään matalassa lämpötilassa, jotta sen tiheys olisi mahdollisimman suuri ja tarvittavan polttoainetankin koko mahdollisimman pieni. Erään raketin polttoainetankin tilavuus on 600,0 m³. Laske, kuinka monta moolia enemmän tähän tankkiin mahtuu nestemäistä metaania, kun lämpötila lasketaan lämpötilasta 111,7 K lämpötilaan 90,7 K. Käytä taulukon tietoja. 6 p.
M(CH₄) = 12,01 g/mol + 4 · 1,008 g/mol = 16,042 g/mol
(1 p.)
Lämpötilassa 111,7 K:
m(CH₄) = 442,4 kg/m³ · 600,0 m³ = 265 440 kg
n(CH₄) = m/M = 265 440 000 g / (16,042 g/mol) = 16,5466 · 10⁶ mol
Lämpötilassa 90,7 K:
m(CH₄) = 451,7 kg/m³ · 600,0 m³ = 271 020 kg
n(CH₄) = m/M = 271 020 000 g / (16,042 g/mol) = 16,8944 · 10⁶ mol
(2 p.)
-
Jos jompi kumpi massoista oikein 1 p.
-
Jos jompi kumpi ainemääristä oikein 1 p.
Lämpötilassa 90,7 K tankkiin mahtuu siis
Δn = 16,8944 · 10⁶ mol − 16,5466 · 10⁶ mol
(1 p.)
= 347,8 · 10³ mol = 347 800 mol enemmän metaania.
(2 p.)
6.2 Kirjoita raketin polttokammiossa tapahtuvan metaanin ja hapen välisen palamisreaktion reaktioyhtälö. 3 p.
Koska lämpötila on yli 3 000 °C, kaikki lähtöaineet ja tuotteet esiintyvät kaasuina:
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
(3 p.)
-
Oikeat aineet 1 p.
-
Oikeiden aineiden lisäksi oikeat kertoimet 1 p. ja oikeat olomuodot 1 p.
6.3 Kuinka paljon lämpöenergiaa vapautuu rakettimoottorin polttokammiossa, jos polttoaineena käytetään 1 mol nestemäistä metaania ja hapettimena nestemäistä happea? Happea on ylimäärin. Käytä taulukon tietoja. 6 p.
Reaktioentalpia voidaan laskea Hessin lain avulla käyttämällä nestemäisten lähtöaineiden höyrystymisentalpioita ja kaasumaisen metaanin palamisentalpiaa seuraavien osareaktioiden mukaisesti:
1: CH₄(l) → CH₄(g), ΔH₁ = 8,17 kJ/mol
(1 p.)
2: O₂(l) → O₂(g), ΔH₂ = 6,82 kJ/mol
Hapen entalpia-arvo pitää kertoa kahdella: 2 · ΔH₂ = 2 · 6,82 kJ/mol = 13,64 kJ/mol
(1 p)
3: CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g), ΔH₃ = −890,7 kJ/mol
(1 p.)
Kokonaisreaktio saadaan muodostettua laskemalla yhteen osareaktiot 1, 2 ja 3.
Kokonaisreaktio on
CH₄(l) + 2O₂(l) → CO₂(g) + 2H₂O(g).
ΔHₖₒₖ = ΔH₁ + 2 · ΔH₂ + ΔH₃ = 8,17 kJ/mol + 2 · 6,82 kJ/mol + (−890,7 kJ/mol) = −868,89 kJ/mol
≈ −869 kJ/mol TAI−900 kJ/mol
Yksi mooli nestemäistä metaania tuottaa siis palaessaan 869 kJ TAI 900 kJ lämpöenergiaa.
(3 p.)
-
Oikea numeerinen tulos 1 p.
-
Oikeat merkitsevät numerot 1 p.
-
Oikea yksikkö 1 p.
-
Energian vapautuminen voi ilmetä negatiivisesta etumerkistä tai olla kuvattu sanallisesti.
7. Etikkahappoliuokset 15 p.
7.1 Kirjoita neutralointireaktion reaktioyhtälö. 3 p.
CH₃COOH(aq) + NaOH(aq) → CH₃COONa(aq) + H₂O(l)
(3 p.)
-
Kaikki aineet oikein 1 p.
-
Oikeiden aineiden lisäksi kaikki kertoimet oikein 1 p. ja kaikki olomuodot oikein 1 p.
7.2 Eräs etaanihappoliuos neutraloitiin natriumhydroksidiliuoksella lämpötilassa 25 °C. Kun happo oli täysin neutraloitu, liuoksen pH-arvo oli 9,25. Mikä oli muodostuneen liuoksen natriumasetaattikonsentraatio? 9 p.
Neutralointireaktiossa muodostuu natriumasetaatin vesiliuos. Vesiliuoksessa vallitsee tasapaino
CH₃COO⁻(aq) + H₂O(l) ⇌ CH₃COOH(aq) + OH⁻(aq).
(1 p.)
-
Oikea reaktioyhtälö voi ilmetä myös oikeasta tasapainotarkastelusta.
pH = 9,25, joten pOH = 14,00 − pH = 14,00 − 9,25 = 4,75.
(1 p.)
\mathrm{[OH^-]} = 10^{-\mathrm{pOH}} = 10^{-4,75} = 1,77828 \cdot 10^{-5} (\mathrm{mol/l})
(1 p.)
Laaditaan tasapainotilannetta kuvaava taulukko, jossa hydroksidi-ionien tasapainokonsentraatio [OH⁻] = x = 1,77828 · 10⁻⁵ mol/l. Merkitään asetaatti-ionien alkukonsentraatioksi a. Tehtävässä ratkaistaan a.
| CH₃COO⁻(aq) | + H₂O(l) | ⇌ | CH₃COOH(aq) | + OH⁻(aq) | |
| Alussa (mol/l) | a | 0 | 0 | ||
| Muutos (mol/l) | −x | +x | +x | ||
| Tasapainossa (mol/l) | a − x | x | x = 1,77828 · 10⁻⁵ |
(2 p.)
Lasketaan emäsvakion arvo:
Kb = Kw / Ka = 1,008 · 10⁻¹⁴ / 1,75 · 10⁻⁵ = 5,76000 · 10⁻¹⁰ (mol/l)
(1 p.)
-
Hyväksytään myös taulukosta katsottu emäsvakion arvo.
Sijoitetaan tasapainokonsentraatiot emäsvakion lausekkeeseen:
K_\mathrm{b}= \frac{\mathrm{[CH_3COOH]\cdot [OH^{-}]}}{\mathrm{[CH_3COO^{-}]}}
(1 p.)
Saadaan Kb = x² / (a − x) ja sijoitetaan x
(1,77828 · 10⁻⁵)² / (a − 1,77828 · 10⁻⁵) = 5,76000 · 10⁻¹⁰,
josta saadaan
a = 0,54901 (mol/l).
(1 p.)
Natriumasetaattiliuoksen konsentraatio oli 0,55 mol/l.
(1 p.)
7.3 Laborantin tehtävänä on neutraloida väkevää etaanihappoliuosta natriumhydroksidiliuoksella. Ohjeen mukaan happoliuos tulee ensin laimentaa vedellä. Tämän jälkeen happoliuokseen tulee lisätä natriumhydroksidia vähän kerrallaan koko ajan sekoittaen. Miksi neutraloinnissa tulee toimia näin? 3 p.
Enintään 3 p. seuraavista:
-
Laimentaminen kasvattaa nesteen määrää, jolloin liuoksen lämpötila nousee vähemmän. (1 p.)
-
Neutralointireaktio vapauttaa runsaasti lämpöä. (1 p.)
-
Kun NaOH:a lisätään liuokseen vähän kerrallaan, liuos ei kuumene liian nopeasti. (1 p.)
-
Kun NaOH:a lisätään liuokseen vähän kerrallaan, ei tule lisättyä liikaa NaOH:a. (1 p.)
-
Jos liuosta sekoitetaan koko ajan, happo ja emäs reagoivat täydellisesti. (1 p.)
-
Liuoksen sekoittaminen estää paikallisten pitoisuuserojen muodostumista. (1 p.)
-
Työskentely on turvallisempaa laimeammalla happoliuoksella. (1 p.)
-
Työskentely on turvallisempaa, jos liuoksen lämpötila ei nouse voimakkaasti. (1 p.)
8. Sähkökemia: sähköpari ja elektrolyysi 15 p.
8.1
Sähköparin eli galvaanisen kennon rakenne on esitetty oheisessa kuvassa.
Kumpi kuvassa esitetyn sähköparin elektrodeista on anodi ja kumpi katodi? Kumpaan suuntaan elektronit liikkuvat elektrodeja yhdistävää johdinta pitkin? Perustele vastauksesi.
7 p.
Sinkkielektrodi on anodi ja nikkelielektrodi on katodi. (2 p.)
Perustelu: Sinkkielektrodilla tapahtuu hapettuminen, koska sinkki on epäjalompi metalli. / Nikkelielektrodilla tapahtuu pelkistyminen, koska nikkeli on jalompi metalli. (2 p.)
Elektronien kulkusuunta: Elektronit liikkuvat johdinta pitkin sinkkielektrodilta nikkelielektrodille. (1 p.)
Perustelu: Sinkkielektrodille kertyy elektroneja metallisen sinkin hapettuessa sinkki-ioneiksi. (\mathrm{Zn(s)}\ \rightarrow\ \mathrm{Zn^{2+}(aq)+2e^-}, reaktioyhtälöä ei vaadita)
TAI
Nikkelielektrodilla kuluu elektroneja nikkeli-ionien pelkistyessä metalliseksi nikkeliksi (\mathrm{Ni^{2+}(aq)+2e^-}\ \rightarrow\ \mathrm{Ni(s)}, reaktioyhtälöä ei vaadita).
(2 p.)
8.2
Sähköparin kennokaavio on
-\mathrm{Co(s)}\ \mid \ \mathrm{Co^{2+}(aq)}\ \parallel \ \mathrm{Cu^{2+}(aq)} \ \mid \ \mathrm{Cu(s)}+.
Kirjoita sähköparin pelkistymisen osareaktion reaktioyhtälö.
Mitä merkintä \parallel kuvaa kennokaaviossa?
3 p.Pelkistymisreaktion reaktioyhtälö on
Cu²⁺ + 2e⁻ → Cu.
(2 p.)
Merkintä \parallel kuvaa suolasiltaa.
(1 p.)
8.3 Magnesiumia voidaan valmistaa elektrolyyttisesti magnesiumkloridisulatteesta. Kuinka monta grammaa puhdasta magnesiumia muodostuu, kun magnesiumkloridiin johdetaan 80 minuutin ajan 1,5 A:n sähkövirta? Kokeessa käytetään grafiittielektrodeja. 5 p.
I = 1,5 A
t = 80 · 60 s = 4 800 s
z = 2
(1 p.)
-
Jos z on väärin, 0 p. ja lopusta osatehtävästä ei voi ansaita pisteitä.
F = 96 485 As/mol
It = nzF, josta saadaan: n = It / (zF).
n = 1,5 A · 4800 s / (2 · 96485 As/mol) = 0,037311 mol
(2 p.)
n = m/M, joten saadaan
m(Mg) = n(Mg) · M(Mg)
= 0,037311 mol · 24,31 g/mol = 0,90704 g ≈ 0,91 g
(2 p.)
Osa 3: 20 pisteen tehtävät
9. Argon 20 p.
9.1 Argon on jalokaasu. Kemistit ajattelivat pitkään, että jalokaasut eivät muodosta kemiallisia yhdisteitä. Tämä käsitys muuttui vasta 1960-luvulla, kun ensimmäiset ksenonyhdisteet syntetisoitiin. Miksi jalokaasut ovat melko inerttejä eli eivät reagoi helposti muiden aineiden kanssa? 3 p.
Enintään 3 p. seuraavista:
-
Jalokaasut eivät helposti luovuta tai ota vastaan elektroneja (2 p.)
TAI
Jalokaasut eivät helposti muodosta kovalenttisia / ionisidoksia muiden aineiden kanssa. (2 p.)
TAIJalokaasuilla on pysyvä/energeettisesti edullinen elektronirakenne. (1 p.)
-
Jalokaasujen uloimmat s- ja p-orbitaalit ovat täysiä. / Jalokaasujen ulkokuorella on oktetti. / Jalokaasuilla on kahdeksan ulkoelektronia. / Jalokaasujen uloin elektronikuori on täysi. (1 p.)
-
Heliumin rakenne poikkeaa muista jalokaasuista, koska sillä on vain kaksi elektronia. (1 p.)
9.2
Lordi Rayleigh teki kokeita, joissa hän pyrki valmistamaan typpeä kahdella eri menetelmällä. Kokeessa A hän poisti ilmasta hapen, hiilidioksidin ja veden. Kokeessa B hän valmisti typpeä kemiallisella reaktiolla. Kokeissa muodostuneet kaasut johdettiin lasipulloihin, joiden tilavuudet olivat samat. Kokeen A lasipullossa kaasuja oli yhteensä 2,3102 g ja kokeen B lasipullossa kaasua oli 2,2990 g. Lämpötila ja paine lasipulloissa olivat kummassakin kokeessa samat.
Yksittäisen aineen osuus seoksessa kuvataan usein mooliosuudella. Mooliosuus on määritelty tekstissä .
Laske argonin mooliosuus kokeessa A olettaen, että kokeen A lasipullossa oli vain typpeä ja argonia ja että kokeessa B muodostui puhdasta typpeä.
10 p.
Koska tilavuus, paine ja lämpötila olivat samat kummassakin kokeessa, on myös kaasujen kokonaisainemäärä n sama. Täten voimme muodostaa seuraavat yhtälöt:
Koe A
mA = nArMAr + nN2MN2 = 2,3102 g
(1 p.)
(1) mA = n(xArMAr + (1 − xAr)MN2) = 2,3102 g
(1 p.)
Koe B
(2) mB = n · MN2 = 2,2990 g
(1 p.)
Jaetaan yhtälö (1) yhtälöllä (2).
xArMAr / MN2 + (1− xAr) = 2,3102 g / 2,2990 g
(2 p.)
-
Mikäli vastauksesta ilmenee jollakin tavalla, että kokeissa A ja B aineiden kokonaisainemäärät olivat samat, nämä pisteet ansaitaan.
xAr(MAr/MN2 −1) = 2,3102 g / 2,2990 g − 1
(2 p.)
xAr = (2,3102 g / 2,2990 g − 1) / (MAr/MN2 −1) = (1,00487 − 1) / ((39,948 g/mol) / (28,02 g/mol) − 1) = 0,011440
(1 p.)
Argonin mooliosuus kokeessa A on siis 0,0114 eli 1,14 %.
(2 p.)
Vaihtoehtoinen ratkaisutapa:
Kokonaisainemäärät kokeissa A ja B ovat samat.
(2 p.)
Koe B
nB = nN2 = mN2 / MN2 = 2,2990 g / 28,02 g/mol = 0,082049 mol
(1 p.)
Koe A
nA = nN2 + nAr = mN2 / MN2 + mAr / MAr = 0,082049 mol
(1 p.)
Merkitään nyt typen massaa x:llä.
nA = x / 28,02 g/mol + (2,3102 g − x) / 39,95 g/mol = 0,082049 mol
(3 p.)
Yhtälöstä voidaan ratkaista x = 2,27274 g eli mAr= 2,3102 g − 2,27274 g = 0,03746 g.
(1 p.)
Argonin mooliosuus
xAr = nAr / nkok = (mAr / MAr) / 0,082049 mol = (0,03746 g / 39,95 g/mol) / 0,082049 mol
xAr = 0,011428 eli 1,14 %
(2 p.)
-
Mikäli argonin massa on laskettu pullojen massan erotuksesta, vain typen ainemäärästä voi ansaita pisteen, eli korkeintaan 1 p. osatehtävästä.
9.3
Laske ilmakehän koostumuksen perusteella argonin mooliosuus näytteessä, joka saadaan, kun ilmasta poistetaan kaikki muut kaasut paitsi argon ja typpi. Hyödynnä taulukkoa .
Miten hyvin laskemasi mooliosuuden arvo vastaa Lordi Rayleighin saamaa argonin mooliosuuden arvoa kokeessa A, jonka laskit osatehtävässä 9.2?
4 p.
Typen tilavuusprosentti ilmakehässä on 78,08 % ja argonin 0,93 %. Koska kaasuilla tilavuussuhde on verrannollinen ainemääräsuhteeseen voidaan mooliosuus laskea tilavuusprosenttien avulla. Argonin mooliosuus ilmanäytteessä, josta on poistettu kaikki muut kaasut on siten
xAr = 0,93 % / (0,93 % + 78,08 %) = 0,011770 ≈ 0,012.
(3 p.)
Argonin mooliosuus Lordi Rayleighin kokeessa A oli osatehtävän 9.2 mukaan 1,14 %. Tämä vastaa hyvin argonin mooliosuutta 1,18 % ilmanäytteessä, joka on tuotettu vastaavalla tavalla kuin Lordi Rayleighin kokeessa.
(1 p.)
-
Pisteen voi ansaita vain mikäli sekä tässä osatehtävässä että osatehtävässä 9.2 on laskettu oikea argonin mooliosuus.
9.4
Ensimmäinen argonin kemiallinen yhdiste syntetisoitiin Helsingin yliopistossa vuonna 2000. Argonfluorihydridin (HArF) synteesi onnistui koelaitteistossa, jonka lämpötila oli 7,5 K. Yhdisteen sidosenergia on hyvin pieni. Miksi HArF:n synteesiin vaadittiin näin matala lämpötila?
3 p.
Koelaitteiston lämpötilan pitää olla hyvin alhainen, jotta ympäristön lämpöenergia ei hajota HArF:n H–Ar ja Ar–F -sidoksia (1 p.), jotka ovat hyvin heikkoja (2 p.).
Vaihtoehtoinen vastaustapa:
Korkeammassa lämpötilassa voi tapahtua tarpeeksi molekyylien välisiä törmäyksiä. (1 p.) Törmäykset johtavat reaktioihin, joissa HArF:n hyvin heikot H–Ar ja Ar–F -sidokset katkeavat. (2 p.)
-
Molemmissa vastaustavoissa HArF:n sidosten heikkous pitää olla mainittu, jotta täydet pisteet voi ansaita.
10. Pilaantuneen maan analysointi 20 p.
Tutustu tekstiin , joka käsittelee pilaantunutta maa-ainesta.
Pilaantuneen maaperän arseenipitoisuus mitattiin atomiabsorptiospektrometrillä. Maanäyte seulottiin ensin 2 mm:n seulan läpi ja siitä punnittiin 0,4852 g näyte. Näytteeseen lisättiin 10 ml happoliuosta, johon näyte liukeni, kun seosta kuumennettiin. Saatu näyteliuos laimennettiin mittapullossa vedellä 100 ml:n tilavuuteen. Mittausta varten mittapullossa olevaa näyteliuosta jatkolaimennettiin pipetoimalla tarkasti 1 ml näyteliuosta 50 ml:n mittapulloon, joka täytettiin merkkiin vedellä.
Analyysiä varten valmistettiin standardiliuokset, joiden pitoisuudet olivat välillä 4,00 µg/l – 20,0 µg/l. Standardiliuosten ja näytteiden absorbanssit mitattiin atomiabsorptiospektrometrillä. Standardien mittaustulokset on koottu taulukkoon .
10.1
Kuvaajassa on esitetty mittaustulosten perusteella piirretty standardisuora.
Standardisuoran yhtälö on
A = 0,017535 l/µg · c − 0,0007000.
Näyteliuoksen absorbanssiksi mitattiin 0,2536. Laske tämän perusteella maanäytteen arseenipitoisuus. Ilmoita arseenipitoisuus käyttäen yksikköä mg/kg.
7 p.Yhtälön avulla lasketaan pitoisuus c, kun absorbanssi on A = 0,2536:
c = (A + 0,0007000) / (0,017535 l/µg) = (0,2536 + 0,0007000) / (0,017535 l/µg) = 14,5024 µg/l
(2 p.)
-
Oikea ratkaisutapa 1 p.
-
Oikea arvo ja yksikkö 1 p.
Huomioidaan näyteliuoksen laimennus:
50 ml / 1 ml · 14,5024 µg/l = 725,12 µg/l
(1 p.)
Huomioidaan, että alussa näyte oli liuotettu 100 ml:aan, eli arseenia oli alkuperäisessä näytteessä
725,1212 µg/l · 0,1000 l = 72,51212 µg = 0,07251212 mg.
(1 p.)
Maanäytteen massa oli 0,4852 g = 0,00004852 kg, joten arseenin pitoisuus maanäytteessä oli
0,07251212 mg / 0,0004852 kg = 149,447895 mg/kg ≈ 149 mg/kg.
(3 p.)
-
Oikea lasku ja tulos 1 p.
-
Oikea numerotarkkuus 1 p.
-
Oikea yksikkö 1 p.
10.2
Kuvaajan standardisuora on laadittu viiden standardiliuoksen avulla. Kahdellakin pisteellä voi määrittää suoran. Miksi standardiliuosten määrän lisääminen parantaa analyysin luotettavuutta?
Mainitse kaksi tapaa, joilla voisit edelleen varmentaa analyysituloksen luotettavuutta.
6 p.
Standardiliuosten lukumäärän lisääminen parantaa analyysin luotettavuutta, koska
- kun useampi mittaus osuu suoralle, standardisuoran luotettavuus/tarkkuus on parempi (2 p.)
- selvästi virheellinen yksittäinen mittaustulos, joka on kaukana muiden pisteiden määrittämästä suorasta, voidaan tunnistaa ja jättää pois sovituksesta. (1 p.)
Vastauksessa on mainittu kaksi tapaa varmistaa analyysituloksen luotettavuutta. Yksi tapa mainittu 1 p., kaksi tapaa mainittu 3 p. Esimerkiksi:
- Mitataan rinnakkaiset näytteet.
- Tehdään uusintamittaus.
- Käytetään jotain muuta menetelmää (esimerkiksi UV/VIS, IC, ICP).
10.3 Miksi näytteestä tehtiin jatkolaimennos? 3 p.
Laitteella on tietty määritysalue, johon näytteen pitoisuuden pitää osua.
Tai:
Näytteen pitoisuuden pitää osua standardisuoralle.
Tai:
Mitattavan näytteen pitoisuuden pitää vastata standardiliuosten pitoisuuksia.
10.4 Miksi arseenipitoisuuden selvittäminen on tärkeää? Voidaanko osatehtävässä 10.1 analysoitua maa-ainesta käyttää asuinalueen täytemaana arseenin määrän perusteella? Perustele vastauksesi. 4 p.
Arseenipitoisuuden selvittäminen on tärkeää, koska arseeni on myrkyllistä/haitallista. (1 p.)
Asetuksen mukaan arseenipitoisuuden ohjearvo on 50 mg/kg. (1 p.)
Koska analysoidun maanäytteen arseenipitoisuus on suurempi kuin ohjearvo, (1 p.) maata ei voida käyttää täytemaana. (1 p.)
-
Jälkimmäiset kaksi pistettä voivat kertyä vain, mikäli osatehtävässä 10.1 on saatu oikea pitoisuus.
(Lisäksi tarvitaan kokonaisriskinarvio.)
11. Hyönteismyrkyn synteesi ja vaikutusmekanismi 20 p.
11.1 Tunnista fluvalinaatin funktionaaliset ryhmät A.–C. (kuvassa ympyröity). 3 p.
-
A. aminoryhmä (1 p.)
-
"Amiiniryhmä", 0 p.
-
-
B. esteriryhmä (1 p.)
-
C. eetteriryhmä (1 p.)
11.2
Fluvalinaattia voidaan valmistaa kahden reaktion kautta lähtöaineista 1–3. Ensimmäinen reaktio on yhdisteiden 1 ja 2 välinen substituutioreaktio, jossa kumpaakin lähtöainetta 1 ja 2 käytetään sama ainemäärä. Reaktion jälkeen reaktioseokseen lisätään emästä sama ainemäärä kuin lähtöainetta 1, ja reaktiotuote puhdistetaan. Puhdistuksen jälkeen tuote reagoi toisessa reaktiossa yhdisteen 3 kanssa.
Piirrä rakennekaavoilla kummankin reaktion tasapainotettu reaktioyhtälö. Mikä on seuraus siitä, että ensimmäisen reaktion jälkeen reaktioseokseen lisätään emästä? Voit käyttää vastauksessasi apuna aineiston rakennekaavoja.
9 p.
Ensimmäinen reaktio:
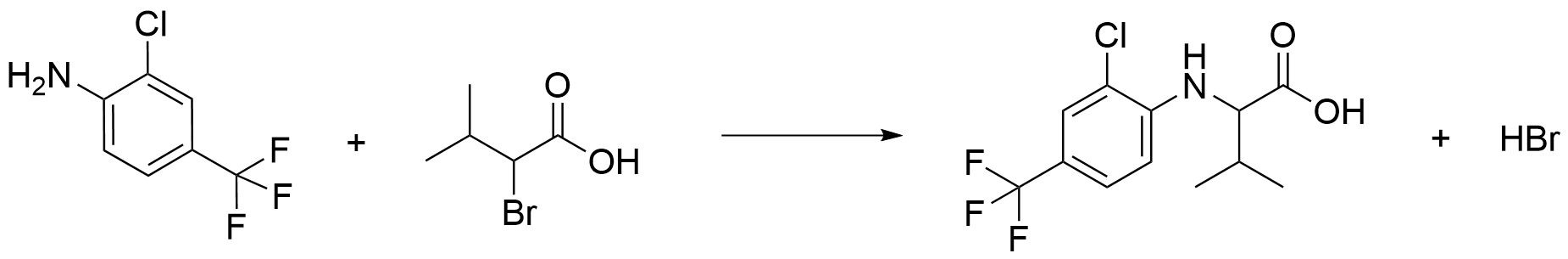 Ensimmäisen reaktion reaktioyhtälö
Ensimmäisen reaktion reaktioyhtälö
Reaktiotuotteena hyväksytään myös:
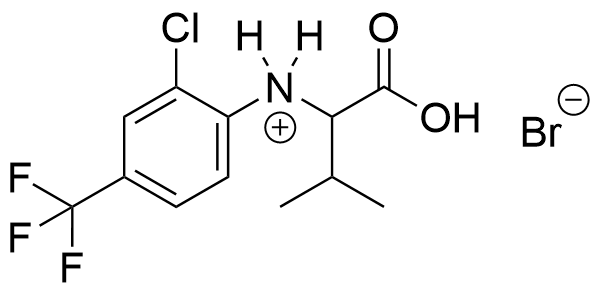 Vaihtoehtoinen hyväksyttävä reaktiotuote
Vaihtoehtoinen hyväksyttävä reaktiotuote
-
Reaktiotuotteet ovat oikein, HBr (1 p.), orgaaninen tuote (3 p.)
-
Muu osa reaktioyhtälöstä ja kertoimet ovat oikein (1 p.)
-
Tämän pisteen voi ansaita vain mikäli myös aiemmat pisteet on ansaittu.
-
Toinen reaktio:
Oikeat lähtöaineet, tuotteet ja kertoimet (2 p.)
Emäksen lisäyksen seurauksena ensimmäisessä reaktiossa muodostuva HBr neutraloituu. (Tästä on hyötyä tuotteen puhdistuksessa.)
(2 p.)
11.3 Lähtöaine 3 hajoaa säilytyksessä hitaasti kahdeksi reaktiotuotteeksi, jotka ovat vetysyanidi (HCN) ja yhdiste X. Piirrä yhdisteen X rakennekaava. Voit käyttää vastauksessasi apuna aineiston rakennekaavoja. 3 p.
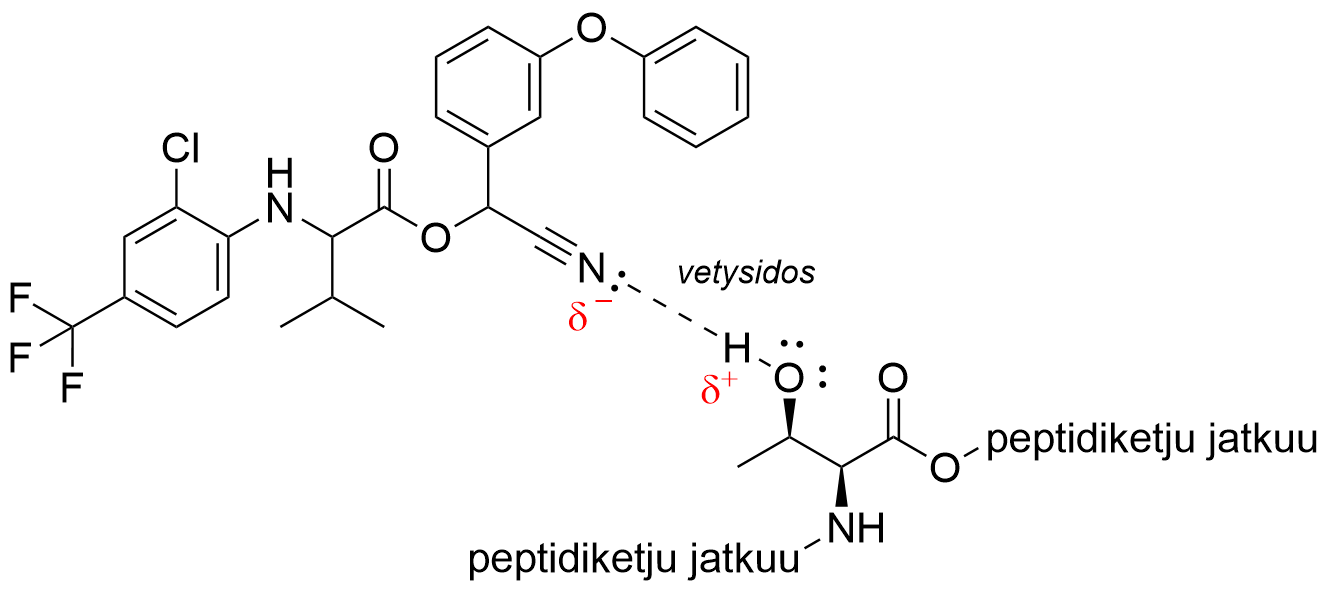
11.4 Pyretroidit sitoutuvat hyönteisten jänniteriippuvaisiin Na⁺-kanaviin, jotka ovat kemialliselta rakenteeltaan proteiineja. Sitoutuminen vaikuttaa hyönteisten hermosolujen toimintaan. Fluvalinaatin sitoutumista proteiiniin tehostaa syanoryhmä, –C≡N. Syanoryhmä sitoutuu proteiinin polypeptidiketjun osana olevan treoniinin sivuryhmään (sivuketjuun). Ohessa on esitetty treoniinin rakennekaava. Millaisia heikkoja sidoksia syanoryhmä voi muodostaa treoniinin sivuryhmään? Perustele vastauksesi. 5 p.
-
Jos vastauksessa on tarkasteltu vahvoja sidoksia, 0 p. koko osatehtävästä.
Treoniinin sivuryhmässä on hydroksiryhmä (–OH). (1 p.)
-
Jos sivuryhmään on kohdistettu muita funktionaalisia ryhmiä, 0 p.
Sidostyyppi on vetysidos/dipoli-dipolisidos. (1 p.)
Korkeintaan 3 p. seuraavista lisähuomioista:
-
Vetysidos on syanoryhmän typpiatomin ja –OH-ryhmän vetyatomin välillä. (2 p.)
-
Oikea kohdistus vaaditaan.
-
-
Vetysidos muodostuu syanoryhmän typpiatomin elektronipariin. (1 p.)
-
Syanoryhmän typpiatomilla on negatiivinen osittaisvaraus. (1 p.)
-
Treoniinin –OH-ryhmän vetyatomilla on positiivinen osittaisvaraus. (1 p.)
-
Syanoryhmän ja treoniinin sivuketjun välillä on myös dispersiovoimia. (1 p.)
-
Syanoryhmän hiiliatomin ja –OH-ryhmän happiatomin välille voi syntyä dipoli-dipolisidos. (1 p.)
Vetysidos treoniinin sivuryhmän ja fluvalinaatin välillä (kuvaa ei vaadita vastaukseen):