Beskrivningar av goda svar: SV – Kemi
23.9.2025
Slutgiltiga beskrivningar av goda svar 13.11.2025
18.11.2025 kl. 13.30 lagt till rätt avrundning av svaret i deluppgift 9.3.
Grunderna enligt vilka bedömningen gjorts framkommer i de slutgiltiga beskrivningarna av goda svar. Uppgiften om hur bedömningsgrunderna tillämpats på examinandens provprestation utgörs av de poäng som examinanden fått för sin provprestation, de slutgiltiga beskrivningarna av goda svar och de föreskrifter gällande bedömningen som nämnden gett i sina föreskrifter och anvisningar. De slutgiltiga beskrivningarna av goda svar innehåller och beskriver inte nödvändigtvis alla godkända svarsalternativ eller alla godkända detaljer i ett godkänt svar. Eventuella bedömningsmarkeringar i provprestationerna anses vara jämställbara med anteckningar och sålunda ger de, eller avsaknaden av markeringar, inte direkta uppgifter om hur bedömningsgrunderna tillämpats på provprestationen.
Med studentexamensprovet utreds om studerandena tillägnat sig de kunskaper och färdigheter som anges i gymnasiets läroplan och uppnått tillräcklig mognad enligt målen för gymnasieutbildningen. Målet för bedömningen i läroämnet kemi är en förståelse för och en tillämpning av den kemiska kunskapen. Vid bedömningen beaktas även de färdigheter med vilka man tillägnar sig experimentell kunskap och förmågan att behandla den. Till sådan kunskap hör till exempel planering av experiment, trygg hantering av arbetsredskap och reagens, presentation och tolkning av resultat samt förmågan att dra slutsatser och tillämpa dem.
Vid bedömningen av uppgifterna i kemi läggs vikten vid ett framställningssätt som betonar läroämnets karaktär och vid precision i begreppen och språkbruket. Reaktionsformlerna ställs upp utan oxidationstal med minsta möjliga heltalskoefficienter och med aggregationstillstånden angivna. I organiska reaktionslikheter används strukturformler, men aggregationstillstånd krävs inte. Olika sätt att skriva strukturformler godkänns.
I beräkningsuppgifter ska storhetsekvationer och formler användas på ett sätt som visar att examinanden förstått uppgiften rätt och tillämpat korrekt princip eller lag i sin lösning. Av svaret framgår entydigt hur man når slutresultatet, men omfattande mellansteg behövs inte. CAS-program kan utnyttjas i uppgiftens olika skeden. De principer och lagar som gäller den aktuella situationen samt uppgiftens slutresultat och de slutsatser som dras utgående från lösningen är av central betydelse och ska framgå av svaret. Slutresultaten ges med enheter och med den noggrannhet som utgångsvärdena kräver, och slutsatserna motiveras.
Mätresultat och grafer som ritats utgående från dessa utnyttjas vid analysen av data och då man drar slutsatser. Till mätpunkterna anpassas en vederbörlig rät linje Värden som ligger mellan mätpunkterna kan interpoleras med ögonmått genom visuell avläsning av grafen eller med hjälp av ett lämpligt program. Axlarnas namn, enheter och skala märks ut i grafen. I grafen anges sådana punkter som är väsentliga för slutsatserna, som ekvivalenspunkten för en titrerkurva eller tangenten som används när man beräknar en hastighet vid en given tidpunkt.
I essäsvar och förklarande svar kompletteras texten med reaktionsformler, ekvationer eller teckningar. Fenomenen som behandlas beskrivs på makroskopisk, mikroskopisk och symbolisk nivå. Av svaret framgår att det material som hör ihop med uppgiften har använts, tillämpats, analyserats och utvärderats i enlighet med uppgiftsformuleringen. Ett svar på god nivå är välstrukturerat och innehållsmässigt konsekvent.
Svaren bedöms enligt de kriterier som gäller för respektive uppgift. Utgångspunkten vid bedömningen är de förtjänster för vilka poäng ansamlas. Om en central kemisk princip saknas eller är felaktig avslutas poängansamlingen. Då godkänns inte fortplantning av det felaktiga resultatet (ej-FF). Exempel på sådana fel är stökiometrifel, fel begränsande faktor samt fel ämne i en reaktionslikhet. För övriga brister eller fel godkänns fortplantning av det felaktiga resultatet (FF), och då fortsätter ansamlingen av poäng efter bristfälligheten eller felet. I de krävande uppgifterna i provets del 3 förutsätts en större precision i behandlingen av principer än i de grundläggande uppgifterna i början av provet. Ur kemisk synvinkel inexakt språkbruk, små räknefel eller slarvig användning av närmevärden orsakar avdrag på 0–3 p. till exempel på följande sätt:
- avrundnings- och kopieringsfel som inte påverkar slutresultatet, −0 p.
- kopieringsfel, avrundningsfel och små slarvfel som påverkar slutresultatet, ett enskilt litet fel i en strukturformel, −1 p.
- enhetsomvandlingsfel, systematiska fel i en strukturformel samt övriga fel som till sin natur är allvarligare än små fel, men där det ändå inte är fråga om en felaktig kemisk princip, −2 p.
Del 1: 20-poängsuppgift
1. Flervalsuppgifter från kemins olika delområden 20 p.
1.1 Vilken av följande tekniker är en kemisk separationsmetod? 2 p.
- extrahering (2 p.)
1.2 Vilken av följande vattenlösningar har det lägsta pH-värdet? Alla lösningar har samma koncentration. 2 p.
- HCl(aq) (2 p.)
1.3 Vilken av följande föreningar löser sig sämst i vatten? 2 p.
- heptan-1-ol (2 p.)
1.4 Vilket av följande ämnen är en vätska vid temperaturen 25 °C och trycket 100 kPa? 2 p.
- propan-1-ol (2 p.)
1.5 Cyklohexans stolform och båtform är sinsemellan 2 p.
- konformationsisomerer. (2 p.)
1.6 Vilket av följande grundämnen finns det mest av i jordskorpan? 2 p.
- aluminium (2 p.)
1.7 I bilden nedan visas hur jämviktsreaktionen A ⇌ B fortskrider som en funktion av tiden. Under vilket tidsintervall är reaktionen framåt snabbast? 2 p.
- under tidsintervallet 0–30 sekunder (2 p.)
1.8 Vilken av följande föreningar kan oxideras så att det bildas en aldehyd? 2 p.
- propan-1-ol (2 p.)
1.9 Vilken av föreningarna nedan har det minsta antalet toppar i ¹H-NMR-spektrumet? 2 p.
- propan-2-on (2 p.)
1.10
Man kan framställa ammoniak i ett slutet kärl med hjälp av följande reaktion:
N₂(g) + 3H₂(g) ⇌ 2NH₃(g).
Vad händer om man tillsätter helium till kärlet? Anta att alla gaserna beter sig som en idealgas.
2 p.- Det bildas lika mycket ammoniak som innan man tillsatte helium. (2 p.)
Del 2: 15-poängsuppgifter
2. Kalciumnitrid 15 p.
När het kalciummetall reagerar med kvävgas bildas kalciumnitrid Ca₃N₂ i fast form.
Reaktionsformeln är
3Ca(s) + N₂(g) → Ca₃N₂(s).
2.1 Ett kalciumprov som har massan 1,2500 g reagerar fullständigt med kvävgas. Kvävgasens temperatur är 25,0 °C och trycket 103,5 kPa. Vilken volym kvävgas behövs? Ge svaret i milliliter. 9 p.
n(Ca) = m(Ca)/M(Ca) = 1,2500 g / (40,08 g/mol) = 0,0311876 mol
(2 p.)
n(N₂) = 1/3 · n(Ca)
(2 p.)
-
Om stökiometrin är felaktig, 0 p. och inga ytterligare poäng ansamlas från resten av deluppgiften.
n(N₂) = 1/3 · 0,0311876 mol = 0,0103959 mol
(1 p.)
pV = nRT, och vi löser ut volymen V.
V(N₂) = n(N₂)RT/p
V(N₂) = [0,0103959 mol · 8,31446 Pa · m³ /(mol · K) · 298,15 K] / 103 500 Pa
(1 p.)
-
Om temperaturen anges i celciusgrader, 0 p. och inga ytterligare poäng ansamlas från resten av deluppgiften.
V(N₂) = 2,48995 · 10⁻⁴ m³
(1 p.)
I svaret ger vi volymen i milliliter i enlighet med uppgiftsformuleringen:
V(N₂) = 2,48995 · 10⁻⁴ m³ · 1 000 000 ml/m³= 248,995 ml ≈ 249,0 ml
(2 p.)
2.2 Vilken slags bindning existerar mellan kalcium och kväve i kalciumnitrid? Motivera ditt svar. 3 p.
Det är en jonbindning (1 p.),
eftersom Ca²⁺- och N³⁻-joner bildas i reaktionen. De här jonerna bildar ett jongitter.
ELLER
eftersom skillnaden i elektronegativitet mellan kalcium och kväve är 2,0.
ELLER
eftersom kalcium är en metall och kväve är en ickemetall.
ELLER
eftersom kalcium har avgett elektroner till kväve / kväve har mottagit elektroner från kalcium.
(2 p.)
-
Om nitridjonen istället är namngiven som kvävejon, högst 1 p.
2.3 Kalciumnitrid reagerar lätt med vätskeformigt vatten. I reaktionen bildas kalciumhydroxid och ammoniak. Skriv reaktionsformeln (reaktionslikheten) för den här reaktionen. 3 p.
Ca₃N₂(s) + 6H₂O(l) → 3Ca(OH)₂(s/aq) + 2NH₃(g/aq)
-
Alla ämnen rätt, 1 p.
-
Därtill alla koefficienter rätt 1 p., och alla aggregationstillstånd rätt 1 p.
3. Livsmedelskemi 15 p.
3.1 Skriv in rätt separationsmetod i luckan. 3 p.
3.1.1 1 p.
- extraktion (1 p.)
- extrahering (1 p.)
3.1.2 1 p.
- filtrering (1 p.)
3.1.3 1 p.
- kromatografi (1 p.)
- olika verkliga kromatografimetoder (1 p.)
3.2 Komplettera följande meningar genom att fylla i orden som saknas. Du ska skriva högst tre ord i varje lucka. 3 p.
3.2.1 1 p.
- homogen (1 p.)
- lösning (1 p.)
3.2.2 1 p.
- en emulsion (1 p.)
- en heterogen blandning (1 p.)
- två faser (1 p.)
- olika faser (1 p.)
3.2.3 1 p.
- två faser (1 p.)
- en fasgräns (1 p.)
- skilda faser (1 p.)
3.3 Komplettera följande meningar genom att fylla i orden som saknas. Du ska skriva högst två ord i varje lucka. 3 p.
3.3.1 1 p.
- ett protein (1 p.)
- ett äggviteämne (1 p.)
3.3.2 1 p.
- denaturering (1 p.)
- koagulering (1 p.)
3.3.3 1 p.
- aminosyror (1 p.)
3.4 Komplettera följande meningar genom att fylla i orden som saknas. Du ska skriva högst två ord i varje lucka. 3 p.
3.4.1 1 p.
- glykosidbindning (1 p.)
- eterbindning (1 p.)
3.4.2 1 p.
- en katalysator (1 p.)
- ett enzym (1 p.)
3.4.3 1 p.
- hydrolysreaktion (1 p.)
3.5 Komplettera följande meningar genom att fylla i orden som saknas. Du ska skriva högst två ord i varje lucka. 3 p.
3.5.1 1 p.
- lösning (1 p.)
- homogen blandning (1 p.)
3.5.2 1 p.
- vätska (1 p.)
- en lösning (1 p.)
- vatten (1 p.)
3.5.3 1 p.
- gas (1 p.)
- luft (1 p.)
Även andra korrekta uttryck godkänns.
-
Små skrivfel godkänns men svaret måste vara entydigt.
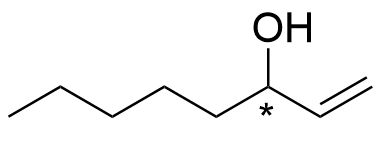
4. Okt-1-en-3-ol, ett lockbete för myggor 15 p.
Människans svett innehåller okt-1-en-3-ol vars ena enantiomer drar till sig myggor. Samma förening används också i myggfällor.
Du kan utnyttja fil när du svarar på deluppgifterna.
4.1 Markera det kirala centrumet, alltså asymmetricentrumet i strukturformeln för okt-1-en-3-ol. 1 p.
4.2 Rita båda enantiomererna (alltså spegelbildsisomererna eller de optiska isomererna) av okt-1-en-3-ol. 4 p.
 Båda enantiomererna för okt-1-en-3-ol
Båda enantiomererna för okt-1-en-3-ol
- Bindningen måste markeras med ett kilformat svärtat eller streckat bindningsstreck.
- Om både kilformat svärtat bindningsstreck och kilformat streckat bindningsstreck har ritats ut men on det kirala centrumets rymdstruktur inte entydigt kan tolkas som en tetraeder, högst 2 p.
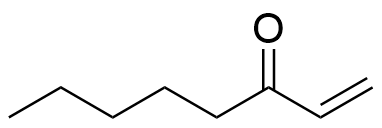
4.3 Hudens doft påverkas av en förening som fungerar som reaktant, alltså utgångsämne, när man framställer okt-1-en-3-ol. När en viss funktionell grupp i den här reaktanten reduceras bildas hydroxigruppen i okt-1-en-3-ol. Rita strukturformeln för reaktanten och namnge den funktionella gruppen som reagerar i reaktanten. 4 p.
4.4 Vilken del av okt-1-en-3-ol är polär och vilken är opolär? Okt-1-en-3-ol löser sig bra i hexan. Vilka svaga bindningar bildar okt-1-en-3-ol med hexan? Mellan vilka delar av molekylerna bildas de här svaga bindningarna? 4 p.
Okt-3-en-ol har en polär hydroxigrupp (1 p.) och en opolär kolvätekedja (1 p.).
Okt-1-en-3-ol bildar dispersionkrafter med hexan (1 p.).
Det bildas dispersionskrafter främst mellan de opolära kolvätestammarna i hexan och i okt-1-en-3-ol.
ELLER
Dispersionskrafter förekommer mellan alla delar av molekylerna. (1 p.)
-
Om andra bindningar än dispersionskrafter beskrivs mellan molekylerna ansamlas enbart poängen för identifiering av den polära och den opolära delen (högst 2 p.).
4.5 Varför är okt-1-en-3-ol svårlösligt i vatten? 2 p.
Polära ämnen löser sig bra i vatten men opolära ämnen löser sig dåligt i vatten.
ELLER
Okt-1-en-3-ol är i huvudsak opolär.
(1 p.)
Enbart hydroxigruppen i okt-1-en-3-ol kan bilda vätebindningar med vattenmolekyler.
(1 p.)
-
Svaret ska innehålla en beskrivning av att vätebindningen är mellan hydroxigruppen och en vattenmolekyl.
5. Järn rostar 15 p.
Järn som rostar är ett exempel på korrosion av metaller. Det första skedet av rostningsprocessen kan beskrivas med följande reaktionsformler:
(1)\ \ \ \mathrm{Fe(s)}\ \rightarrow \ \mathrm{Fe^{2+}(aq)+2e^-}
(2)\ \ \ \mathrm{O_2(g)+2H_2O(l)+4e^-}\ \rightarrow \ \mathrm{4OH^-(aq)}
5.1 Är det en spontan reaktion när järn rostar? Motivera ditt svar. Utnyttja normalpotentialerna för delreaktionerna (1) och (2) i ditt svar. 5 p.
Delreaktionernas normalpotentialer:
(1)\ \ \ \mathrm{Fe(s)}\rightarrow\mathrm{Fe^{2+}(aq)+2e^-}\ \ \ E°=+0{,}45\ \mathrm{V}
(2)\ \ \ \mathrm{O_2(g)+2H_2O(l)+4e^-}\ \rightarrow\ \mathrm{4OH^-(aq)}\ \ \ E°=+0{,}40\ \mathrm{V}
(2 p.)
-
Reaktionsformlerna krävs inte i svaret.
Totalpotentialen (cellpotentialen) för reduktions-oxidationsreaktionen är 0,45 V + 0,40 V = +0,85 V.
(1 p.)
Eftersom totalpotentialen är positiv
(1 p.)
är det en spontan reaktion när järn rostar.
(1 p.)
5.2 Beskriv en metod för att förhindra att järn rostar eller för att bromsa rostandet. Motivera kemiskt den metod som du beskriver. 4 p.
En metod nämns i svaret (2 p.) och en motivering är given (2 p.) (men en bristfällig motivering ger ändå högst 1 p.). Exempel:
-
Metod: ytbeläggning med till exempel plast, målfärg eller olja.
Motivering: Metallens yta kommer inte i kontakt med oxiderande ämnen. -
Metod: ytbeläggning med en oädlare metall, till exempel galvanisering alltså ytbeläggning med zink.
Motivering: Zink är en oädlare metall än järn. Zink oxideras också lättare än järn. Vid galvaniseringen bildas ett skikt av zinkoxid som skyddar järnet från att oxideras. -
Metod: En offeranod eller offermetall fästs vid järnet.
Motivering: Offeranoden består av en metall som är oädlare än järn. Den mindre ädla metallen oxideras i stället för det ädlare järnet. -
Metod: Järnet hålls torrt eller konstruktioner utformas så att vatten inte blir stående i konstruktionen.
Motivering: Fukt försnabbar rostandet. Syre reagerar snabbare med järnet när syret är upplöst i vatten jämfört med att syret är en gas i luften. Vattnet fungerar som en elektrolytlösning i vilken joner kan röra på sig. -
Metod: Ytorna slipas så de blir släta.
Motivering: Den reaktiva ytans areal är mindre än för en ojämn metallyta. (Dessutom stannar fukt lättare kvar på en ojämn yta än på en slät yta.) -
Metod: Ytbeläggning med en metall som bildar ett passivt/tätt oxidlager (till exempel Al, Cr eller Zn).
Motivering: Ytbeläggningens täta oxidlager hindrar att oxiderande ämnen kommer i kontakt med järnet. -
Metod: Ytbeläggning med en ädlare metall.
Motivering: En ädlare metall oxideras inte lika lätt som järn och kan på så sätt skydda järnet från inverkan av oxiderande ämnen. -
Metod: Skydda järnet från sura vattenlösningar.
Motivering: Sura vattenlösningar innehåller rikligt med vätejoner vilka påskyndar rostandet av metallen. -
Metod: Skydda järnet från salthaltiga vattenlösningar.
Motivering: Upplösta salter ökar vattnets konduktivitet och då är vattnet en effektivare elektrolytlösning, vilket påskyndar rostandet.
5.3
Planera ett experiment för att utreda inverkan av en metod för att hindra att järn rostar eller som gör att det rostar långsammare. Experimentet ska gå att utföra med redskap som finns i ett skollaboratorium.
Beskriv hur experimentet genomförs, vilken faktor som förändras i experimentet, vilka faktorer som hålls oförändrade och vilka observationer som görs under experimentet.
6 p.
Metoden som används för att sakta ned eller hindra att järn rostar är meningsfull ur kemisk synvinkel. Ur beskrivningen av experimentets upplägg framgår hur experimentet utförs och vilka observationer som ska göras under experimentet (3 p.) samt vilken faktor som förändras under experimentet och vilka faktorer som hålls oförändrade (3 p.).
Till exempel:
I experimentet undersöks två likadana järnspikar. Den ena spiken målas medan den andra spiken är obehandlad. Spikarna sätts i likadana kärl som innehåller lika mycket saltlösning. Saltlösningarna har samma koncentration. Kärlen förvaras under likadana förhållanden en viss tid. Sedan jämförs mängden rost på spikarna genom visuell inspektion eller genom vägning.
Poängsättning av exemplet:
-
Metoden som valts för att skydda metallen (målning) är vettig. (1 p.)
-
Faktorn som förändras under experimentet: Det ena provobjektet målas och det andra målas inte. (1 p.)
-
Experimentets utförande: Utförandet har beskrivits tydligt. (1 p.)
-
Om experimentets utförande är sådant att metodens inverkan för att skydda från rostning inte kan påvisas, 0 p. och inga ytterligare poäng ansamlas från den resterande delen av deluppgiften.
-
-
Faktorerna som hålls oförändrade: Alla redskap som används i experimentet, som spikarna, kärlen och saltlösningarna är likadana. (1 p.)
-
Experimentets yttre förhållanden ELLER tiden för experimentet är likadana. (1 p.)
-
Observationerna som görs i experimentet: Mängden rost på provobjekten jämförs visuellt eller genom vägning. (1 p.)
6. Metan som raketbränsle 15 p.
6.1 Det vätskeformade metanet lagras vid låg temperatur för att maximera dess densitet och därigenom minimera bränsletankens volym. En viss bränsletank i en raket har volymen 600,0 m³. Beräkna hur många mol mer vätskeformad metan som kan lagras i den här tanken när temperaturen sänks från 111,7 K till 90,7 K. Använd information ur tabell . 6 p.
M(CH₄) = 12,01 g/mol + 4 · 1,008 g/mol = 16,042 g/mol
(1 p.)
Vid temperaturen 111,7 K:
m(CH₄) = 442,4 kg/m³ · 600,0 m³ = 265 440 kg
n(CH₄) = m/M = 265 440 000 g / (16,042 g/mol) = 16,5466 · 10⁶ mol
Vid temperaturen 90,7 K:
m(CH₄) = 451,7 kg/m³ · 600,0 m³ = 271 020 kg
n(CH₄) = m/M = 271 020 000 g / (16,042 g/mol) = 16,8944 · 10⁶ mol
(2 p.)
-
Någondera av massorna är rätt, 1 p.
-
Någondera av substansmängderna är rätt, 1 p.
Vid temperaturen 90,7 K ryms det alltså
Δn = 16,8944 · 10⁶ mol − 16,5466 · 10⁶ mol
(1 p.)
= 347,8 · 10³ mol = 347 800 mol mera metan i tanken.
(2 p.)
6.2 Skriv reaktionsformeln (reaktionslikheten) för förbränningsreaktionen mellan metan och syre i raketens förbränningskammare. 3 p.
Eftersom temperaturen är över 3 000 °C förekommer alla utgångsämnen och produkter som gaser:
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g)
(3 p.)
-
Alla ämnen rätt, 1 p.
-
Därtill alla koefficienter rätt 1 p., och alla aggregationstillstånd rätt 1 p.
6.3 Hur mycket värmeenergi frigörs i raketmotorns förbränningskammare om man använder 1 mol vätskeformat metan som bränsle och vätskeformat syre som oxidationsmedel? Det finns syre i överskott. Använd information ur tabell . 6 p.
Reaktionsentalpin kan beräknas med hjälp av Hess lag genom att använda ångbildningsentalpierna för de vätskeformade reaktanterna och förbränningsentalpin för metan enligt följande delreaktioner:
1: CH₄(l) → CH₄(g), ΔH₁ = 8,17 kJ/mol
(1 p.)
2: O₂(l) → O₂(g), ΔH₂ = 6,82 kJ/mol
Syrets entalpivärde ska multipliceras med två: 2 · ΔH₂ = 2 · 6,82 kJ/mol = 13,64 kJ/mol
(1 p)
3: CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(g), ΔH₃ = −890,7 kJ/mol
(1 p.)
Totalreaktionen erhålls genom att räkna ihop delreaktionerna 1, 2 och 3.
Totalreaktionen är
CH₄(l) + 2O₂(l) → CO₂(g) + 2H₂O(g).
ΔHₜₒₜ = ΔH₁ + 2 · ΔH₂ + ΔH₃ = 8,17 kJ/mol + 2 · 6,82 kJ/mol + (−890,7 kJ/mol) = −868,89 kJ/mol
≈ −869 kJ/mol ELLER −900 kJ/mol
När en mol vätskeformad metan brinner produceras det alltså 869 kJ ELLER 900 kJ värmeenergi.
(3 p.)
-
Rätt numeriska svar 1 p.
-
Rätt antal gällande siffror 1 p.
-
Rätt enhet 1 p.
-
Det att energin frigörs kan framgå utifrån negativt förtecken eller beskrivas i ord.
7. Ättiksyralösningar 15 p.
7.1 Skriv reaktionsformeln för neutralisationsreaktionen. 3 p.
CH₃COOH(aq) + NaOH(aq) → CH₃COONa(aq) + H₂O(l)
(3 p.)
-
Alla ämnen rätt, 1 p.
-
Därtill alla koefficienter rätt 1 p., och alla aggregationstillstånd rätt 1 p.
7.2 En etansyralösning neutraliserades med natriumhydroxidlösning vid temperaturen 25 °C. När syran var helt neutraliserad var lösningens pH-värde 9,25. Vilken var natriumacetatkoncentrationen i lösningen som bildats? 9 p.
I neutralisationsreaktionen bildas en vattenlösning av natriumacetat. I vattenlösningen råder följande jämvikt:
CH₃COO⁻(aq) + H₂O(l) ⇌ CH₃COOH(aq) + OH⁻(aq).
(1 p.)
-
Den rätta reaktionsformeln kan framgå ur en korrekt beskrivning av jämvikten.
pH = 9,25, så vi får pOH = 14,00 − pH = 14,00 − 9,25 = 4,75.
(1 p.)
\mathrm{[OH^-]} = 10^{-\mathrm{pOH}} = 10^{-4,75} = 1,77828 \cdot 10^{-5} (\mathrm{mol/l})
(1 p.)
Vi ställer upp en tabell som beskriver jämviktssituationen. Hydroxidjonernas jämviktskoncentration är [OH⁻] = x = 1,77828 · 10⁻⁵ mol/l. Vi betecknar koncentrationen för acetatjonerna i början med a. I uppgiften ska vi bestämma a.
| CH₃COO⁻(aq) | + H₂O(l) | ⇌ | CH₃COOH(aq) | + OH⁻(aq) | |
| I början (mol/l) | a | 0 | 0 | ||
| Förändring (mol/l) | −x | +x | +x | ||
| Vid jämvikt (mol/l) | a − x | x | x = 1,77828 · 10⁻⁵ |
(2 p.)
Vi beräknar värdet för baskonstanten:
Kb = Kw / Ka = 1,008 · 10⁻¹⁴ / 1,75 · 10⁻⁵ = 5,76000 · 10⁻¹⁰ (mol/l)
(1 p.)
-
Värdet för baskonstanten kan också tas ur en tabellsamling.
Vi sätter in jämviktskoncentrationerna i uttrycket för baskonstanten:
K_\mathrm{b}= \frac{\mathrm{[CH_3COOH]\cdot [OH^{-}]}}{\mathrm{[CH_3COO^{-}]}}
(1 p.)
Vi får Kb = x² / (a − x) och sedan sätter vi in värdet för x:
(1,77828 · 10⁻⁵)² / (a − 1,77828 · 10⁻⁵) = 5,76000 · 10⁻¹⁰,
och då får vi
a = 0,54901 (mol/l).
(1 p.)
Koncentrationen för natriumacetatlösningen var 0,55 mol/l.
(1 p.)
7.3 En laborant hade som uppgift att neutralisera en koncentrerad ättiksyralösning med natriumhydroxidlösning. Enligt instruktionerna ska syralösningen först spädas med vatten. Sedan ska man tillsätta natriumhydroxid i syralösningen lite i taget och röra om hela tiden. Varför ska man göra så här vid neutralisationen? 3 p.
Högst 3 p. ansamlas från följande:
-
Genom utspädningen är vätskans volym större och då får vi en mindre temperaturhöjning för lösningen. (1 p.)
-
Neutralisationsreaktionen frigör rikligt med värme. (1 p.)
-
Lösningen upphettas inte för snabbt om NaOH tillsätts lite i taget till lösningen. (1 p.)
-
När man tillsätter lite NaOH i taget till lösningen undviker man att tillsätta för mycket NaOH. (1 p.)
-
Kontinuerlig omrörning av lösningen får syran och basen att reagera fullständigt. (1 p.)
-
Omrörning av lösningen hindrar att det uppstår lokala koncentrationsskillnader. (1 p.)
-
Arbetet är säkrare då man använder en mer utspädd syralösning. (1 p.)
-
Arbetet är säkrare då lösningens temperatur inte stiger kraftigt. (1 p.)
8. Elektrokemi: galvaniskt element och elektrolys 15 p.
8.1
Strukturen för ett galvaniskt element visas i bilden invid.
Vilken av elektroderna i det galvaniska elementet är anod och vilken är katod? I vilken riktning går elektronerna längs elledaren som förenar elektroderna? Motivera ditt svar.
7 p.
Zinkelektroden är anod och nickelelektroden är katod. (2 p.)
Motivering: Vid zinkelektroden sker oxidation för zink är en oädlare metall. / Vid nickelelektroden sker reduktion för nickel är en ädlare metall. (2 p.)
Elektronernas riktning: Elektronerna går längs ledningen från zinkelektroden till nickelelektroden. (1 p.)
Motivering: Vid zinkelektroden ansamlas elektroner när det metalliska zinket oxideras till zinkjoner (\mathrm{Zn(s)}\ \rightarrow\ \mathrm{Zn^{2+}(aq)+2e^-}, reaktionsformeln krävs inte).
ELLER
Vid nickelelektroden förbrukas elektroner när nickeljoner reduceras till metalliskt nickel (\mathrm{Ni^{2+}(aq)+2e^-}\ \rightarrow\ \mathrm{Ni(s)}, reaktionsformeln krävs inte).
(2 p.)
8.2
Cellschemat för ett galvaniskt element är
-\mathrm{Co(s)}\ \mid \ \mathrm{Co^{2+}(aq)}\ \parallel \ \mathrm{Cu^{2+}(aq)} \ \mid \ \mathrm{Cu(s)}+.
Skriv reaktionsformeln (reaktionslikheten) för delreaktionen för reduktionen i det galvaniska elementet.
Vad betyder beteckningen \parallel i cellschemat?
3 p.Reaktionsformeln för reduktionsreaktionen är
Cu²⁺ + 2e⁻ → Cu.
(2 p.)
Beteckningen \parallel används för att beskriva saltbryggan.
(1 p.)
8.3 Man kan framställa magnesium på elektrolytisk väg ur en smälta av magnesiumklorid. Hur många gram rent magnesium bildas när man leder en 1,5 A:n elström genom magnesiumkloriden under tiden 80 minuter? I experimentet använder man grafitelektroder. 5 p.
I = 1,5 A
t = 80 · 60 s = 4 800 s
z = 2
(1 p.)
-
Om z är fel, 0 p., och inga poäng ansamlas för resten av uppgiften.
F = 96 485 As/mol
It = nzF, och vi får: n = It / (zF).
n = 1,5 A · 4800 s / (2 · 96485 As/mol) = 0,037311 mol
(2 p.)
n = m/M, och vi får
m(Mg) = n(Mg) · M(Mg)
= 0,037311 mol · 24,31 g/mol = 0,90704 g ≈ 0,91 g
(2 p.)
Del 3: 20-poängsuppgifter
9. Argon 20 p.
9.1 Argon är en ädelgas. Kemisterna antog länge att ädelgaser inte bildar kemiska föreningar. Den här uppfattningen ändrades först på 1960-talet, när man syntetiserade de första xenonföreningarna. Varför är ädelgaserna rätt så inerta, det vill säga de reagerar inte lätt med andra ämnen? 3 p.
Högst 3 p. ansamlas från följande:
-
Ädelgaser avger eller mottar inte elektroner lätt. (2 p.)
ELLER
Ädelgaser bildar inte kovalenta bindningar / jonbindningar med andra ämnen lätt. (2 p.)
ELLER
Ädelgaserna har en en stabil / energetiskt fördelaktig elektronstruktur. (1 p.) -
I ädelgasatomerna är de yttersta s- och p-orbitalerna fyllda. / I ädelgasatomerna är det oktett på det yttersta skalet. / I ädelgasatomerna finns det åtta valenselektroner. / I ädelgasatomerna är det yttersta elektronskalet fullt. (1 p.)
-
Elektronstrukturen för helium avviker från de övriga ädelgaserna eftersom det bara finns två elektroner i heliumatomen. (1 p.)
9.2
Lord Rayleigh utförde experiment där han försökte framställa kväve med två olika metoder. I experiment A avlägsnade han syret, koldioxiden och vattnet från luften. I experiment B framställde han kväve genom en kemisk reaktion. Gaserna som bildades i dessa experiment leddes in i glasflaskor som hade samma volym. I experiment A fanns det sammanlagt 2,3102 g gaser i glasflaskan och i experiment B fanns det 2,2990 g gas i glasflaskan. I båda experimenten hade man samma temperatur och tryck i glasflaskorna.
Molandel används ofta för att beskriva andelen av ett enskilt ämne i en blandning. Molandelen definieras i text .
Beräkna molandelen för argon i experiment A. Anta att glasflaskan i experiment A innehöll bara kväve och argon och att det i experiment B bildades rent kväve.
10 p.
Eftersom volymen, trycket och temperaturen är desamma i båda experimenten är den totala substansmängden n för gaserna också densamma. Därmed kan vi ställa upp följande ekvationer:
Experiment A
mA = nArMAr + nN2MN2 = 2,3102 g
(1 p.)
(1) mA = n(xArMAr + (1 − xAr)MN2) = 2,3102 g
(1 p.)
Experiment B
(2) mB = n · MN2 = 2,2990 g
(1 p.)
Vi dividerar ekvation (1) med ekvation (2).
xArMAr / MN2 + (1− xAr) = 2,3102 g / 2,2990 g
(2 p.)
-
De ovannämnda poängen ansamlas om det ur svaret på något sätt framgår att de totala substansmängderna i experiment A och experiment B är samma.
xAr(MAr/MN2 −1) = 2,3102 g / 2,2990 g − 1
(2 p.)
xAr = (2,3102 g / 2,2990 g − 1) / (MAr/MN2 −1) = (1,00487 − 1) / ((39,948 g/mol) / (28,02 g/mol) − 1) = 0,011440
(1 p.)
Molandelen för argon i experiment A var alltså 0,0114 eller 1,14 %.
(2 p.)
Ett alternativt sätt att lösa uppgiften:
De sammanlagda substansmängderna är desamma i båda experimenten A och B.
(2 p.)
Experiment B
nB = nN2 = mN2 / MN2 = 2,2990 g / 28,02 g/mol = 0,082049 mol
(1 p.)
Experiment A
nA = nN2 + nAr = mN2 / MN2 + mAr / MAr = 0,082049 mol
(1 p.)
Vi betecknar nu massan för kväve med x.
nA = x / 28,02 g/mol + (2,3102 g − x) / 39,95 g/mol = 0,082049 mol
(3 p.)
Ur ekvationen kan vi lösa ut x = 2,27274 g och då får vi mAr= 2,3102 g − 2,27274 g = 0,03746 g.
(1 p.)
Molandelen för argon
xAr = nAr / ntot = (mAr / MAr) / 0,082049 mol = (0,03746 g / 39,95 g/mol) / 0,082049 mol
xAr = 0,011428 eller 1,14 %
(2 p.)
-
Om massan för argon är beräknad utifrån skillnaden mellan de två flaskornas massor kan poäng bara ansamlas för kvävets substansmängd, alltså högst 1 p. för deluppgiften.
9.3
Utgå från atmosfärens sammansättning och beräkna molandelen för argon i ett prov som erhålls när man avlägsnar alla andra gaser ur luften utom argon och kväve. Använd tabell .
Hur väl överensstämmer det värde som du räknat ut för molandelen med värdet för argons molandel som Lord Rayleigh erhöll i experiment A och som du beräknade i deluppgift 9.2?
4 p.
Volymprocenten för kväve i atmosfären är 78,08 % och för argon 0,93 %. Förhållandet mellan gasers volymer är proportionellt mot förhållandet mellan deras substansmängder. Därför kan molandelen beräknas med hjälp av procentuella volymandelar. Molandelen för argon i ett luftprov från vilket alla andra gaser har avlägsnats är därmed
xAr = 0,93 % / (0,93 % + 78,08 %) = 0,011770 ≈ 0,012.
(3 p.)
I Lord Rayleighs experiment A var molandelen för argon 1,14 % enligt deluppgift 9.2. Det här motsvarar väl molandelen för argon 1,18 % i ett luftprov som har framställts på motsvarande sätt som i Lord Rayleighs experiment.
(1 p.)
-
Den här poängen ansamlas bara om rätt molandel har beräknats för argon i både deluppgift 9.2 och i den här deluppgiften.
9.4
Den första kemiska föreningen med argon syntetiserades vid Helsingfors universitet år 2000. Syntesen av argonfluorhydrid (HArF) kunde framgångsrikt utföras i en försöksapparatur där temperaturen var 7,5 K. Föreningens bindningsenergi är mycket låg. Varför krävs det en så låg temperatur när man syntetiserar HArF?
3 p.
Temperaturen i försöksapparaturen måste vara mycket låg så att inte omgivningens värmeenergi bryter H–Ar- och Ar–F-bindningarna (1 p.) som är mycket svaga (2 p.).
Ett alternativt sätt att svara:
Vid en högre temperatur kan det ske tillräckligt många kollisioner mellan molekyler. (1 p.) Kollisionerna leder till reaktioner där H–Ar- och Ar–F-bindningarna, som är mycket svaga, brister. (2 p.)
-
I båda svarsmodellerna krävs för fulla poäng ett omnämnande om att bindningarna är svaga.
10. Analys av förorenad mark 20 p.
Studera text som handlar om förorenad mark.
Arsenikhalten i förorenad mark mättes med en atomabsorptionsspektrometer. Jordprovet siktades först genom en 2 mm sikt och sedan vägde man upp ett prov på 0,4852 g. Till provet tillsattes 10 ml syralösning och när man hettade upp blandningen löstes provet i syralösningen. Provlösningen som erhölls späddes med vatten i en mätkolv till volymen 100 ml. För mätningen späddes provlösningen i mätkolven ytterligare genom att noggrant pipettera 1 ml provlösning i en 50 ml mätkolv som fylldes till markeringen med vatten.
För analysen framställde man standardlösningar med halter från 4,00 µg/l till 20,0 µg/l. Man mätte absorbanserna för standardlösningarna och för proven med en atomabsorptionsspektrometer. Mätresultaten för standardlösningarna har sammanställts i tabell .
10.1
I graf visas standardlinjen som ritats upp utifrån mätresultaten.
Standardlinjens ekvation är
A = 0,017535 l/µg · c − 0,0007000.
Provlösningens absorbans uppmättes till 0,2536. Beräkna arsenikhalten i jordprovet utifrån den här informationen. Ange arsenikhalten med enheten mg/kg.
7 p.Vi använder ekvationen för att beräkna halten c när absorbansen är A = 0,2536:
c = (A + 0,0007000) / (0,017535 l/µg) = (0,2536 + 0,0007000) / (0,017535 l/µg) = 14,5024 µg/l
(2 p.)
-
Ekvationen är löst på rätt sätt 1 p.
-
Rätt talvärde och enhet 1 p.
Vi beaktar utspädningen av provlösningen:
50 ml / 1 ml · 14,5024 µg/l = 725,12 µg/l
(1 p.)
Vi beaktar att provet i början var upplöst i 100 ml, det vill säga i det ursprungliga provet var arsenikmängden
725,1212 µg/l · 0,1000 l = 72,51212 µg = 0,07251212 mg.
(1 p.)
Jordprovet hade massan 0,4852 g = 0,00004852 kg, så halten av arsenik i jordprovet var
0,07251212 mg / 0,0004852 kg = 149,447895 mg/kg ≈ 149 mg/kg.
(3 p.)
-
Rätt uträkning och resultat 1 p.
-
Rätt siffernoggrannhet 1 p.
-
Rätt enhet 1 p.
10.2
Standardlinjen i graf har ritats upp med hjälp av fem standardlösningar. Man kan också bestämma en linje utifrån två punkter. Varför blir analysens tillförlitlighet bättre då man använder flera standardlösningar?
Nämn två sätt på vilka du ytterligare kunde försäkra dig om analysresultatets tillförlitlighet.
6 p.
Tillförlitligheten förbättras då antalet standardlösningar utökas. Förklaring:
- Då flera mätresultat infaller på linjen blir standardlinjens tillförlitlighet / noggrannhet bättre. (2 p.)
- Man kan identifiera ett klart felaktigt mätvärde som är långt från linjen som definieras av de övriga mätvärdena. Då kan det felaktiga värdet utelämnas från anpassningen. (1 p.)
I svaret nämns två sätt att försäkra sig om analysresultatets tillförlitlighet. Om ett sätt har omnämnts, 1 p., om två sätt har omnämnts, 3 p. Till exempel:
- Man mäter upp parallella prover.
- Man upprepar mätningen.
- Man använder någon annan metod (till exempel UV/VIS, IC, ICP).
10.3 Varför späddes provet ytterligare? 3 p.
För apparaten finns det ett specifikt område som bestämningen kan göras inom. Provets halt måste överensstämma med det här mätområdet.
Eller:
Halten för provet måste passa in på standardlinjen.
Eller:
Halten för det uppmätta provet måste motsvara halterna för standardlösningarna.
10.4 Varför är det viktigt att ta reda på arsenikhalten? Kan jorden som analyserades i deluppgift 10.1 användas som fyllnadsjord i ett bostadsområde, utifrån mängden arsenik? Motivera ditt svar. 4 p.
Det är viktigt att bestämma halten för arsenik på grund av att arsenik är giftigt/skadligt. (1 p.)
Enligt förordningen är riktvärdet för arsenik 50 mg/kg. (1 p.)
Eftersom arsenikhalten i det analyserade jordprovet överstiger riktvärdet (1 p.) kan jorden inte användas som fyllnadsjord. (1 p.)
-
De två sistnämnda poängen kan enbart ansamlas om rätt halt har beräknats i deluppgift 10.1.
(Därtill måste man göra en helhetsbedömning av riskerna.)
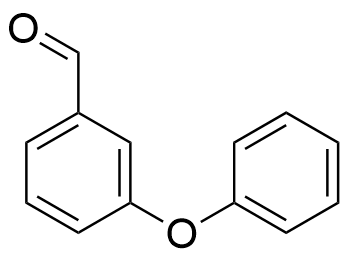
11. Syntes och funktion för ett insektsmedel 20 p.
11.1 Identifiera de funktionella grupperna A.–C. (som är inringade i bilden). 3 p.
-
A. aminogrupp (1 p.)
-
"Amingrupp", 0 p.
-
-
B. estergrupp (1 p.)
-
C. etergrupp (1 p.)
11.2
Man kan framställa fluvalinat genom två reaktioner utgående från utgångsämnena 1–3. Den första reaktionen är en substitutionsreaktion mellan föreningarna 1 och 2. I reaktionen använder man samma substansmängd av vardera utgångsämnet 1 och 2. Efter reaktionen tillsätter man en bas i lika stor substansmängd som man hade av utgångsämne 1 och sedan rengör man produkten. Efter rengöringen reagerar produkten i den andra reaktionen med förening 3.
Rita upp de balanserade reaktionsformlerna (reaktionslikheterna) för båda reaktionerna med strukturformler. Vilken är följden av att man efter den första reaktionen tillsätter en bas till reaktionsblandningen? Du kan använda strukturformlerna i material som hjälp i ditt svar.
9 p.
Den första reaktionen:
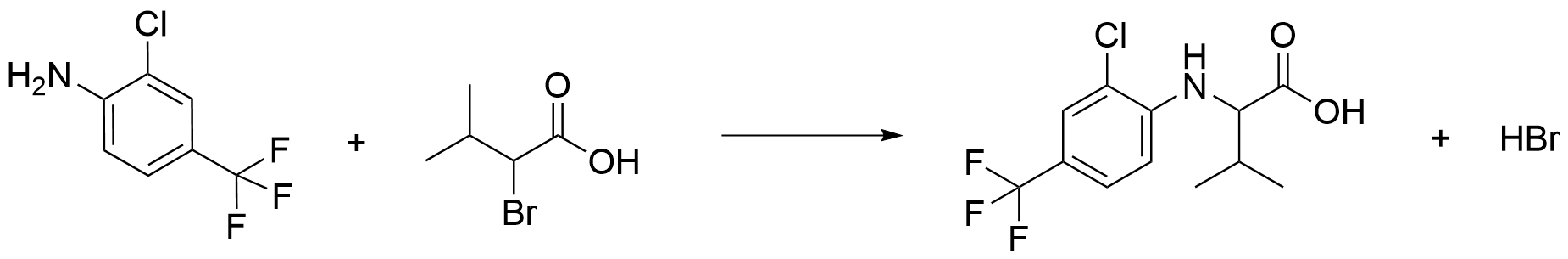 Reaktionsformeln för den första reaktionen
Reaktionsformeln för den första reaktionen
Som reaktionsprodukt godkänns också:
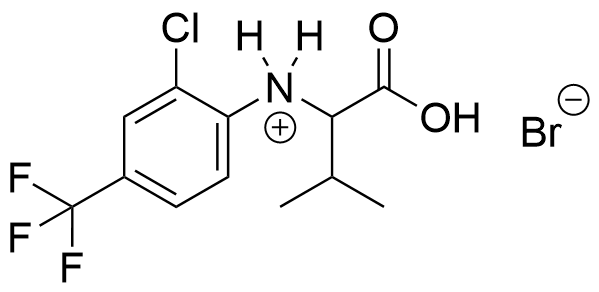 En alternativ reaktionsprodukt som godkänns
En alternativ reaktionsprodukt som godkänns
-
Reaktionsprodukterna är rätt, HBr (1 p.), den organiska produkten (3 p.)
-
Därtill är resten av reaktionsformeln och koefficienterna rätt (1 p.).
-
Den här poängen kan ansamlas bara om de tidigare poängen har ansamlats.
-
Den andra reaktionen:
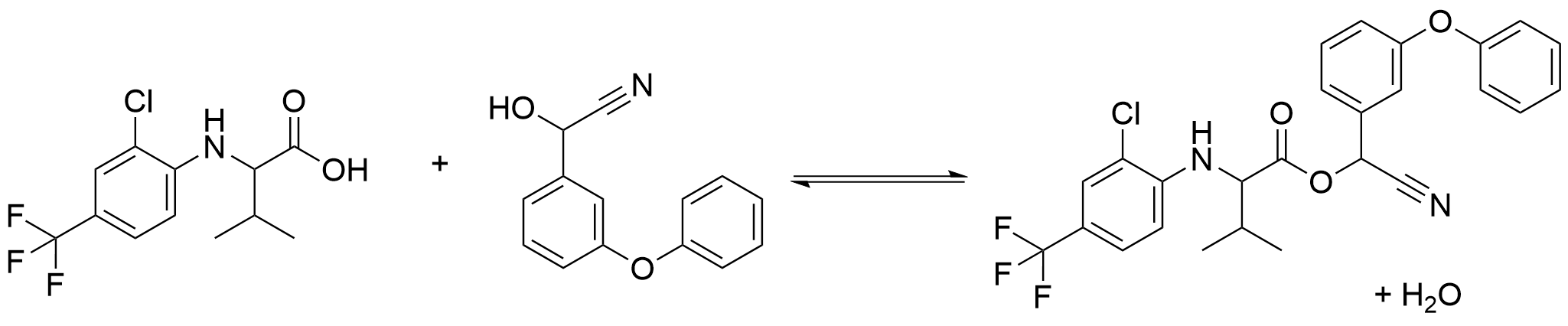 Reaktionsformeln för den andra reaktionen
Reaktionsformeln för den andra reaktionen
Rätt utgångsämnena, produkter och koefficienter (2 p.)
Tillsatsen av bas leder till att HBr som bildas i den första reaktionen neutraliseras. (Det här är till nytta vid rengöringen av produkten.)
(2 p.)
11.3 Utgångsämne 3 sönderfaller långsamt under förvaring till två produkter. De här produkterna är vätecyanid (HCN) och förening X. Rita strukturformeln för förening X. Du kan använda strukturformlerna i material som hjälp i ditt svar. 3 p.
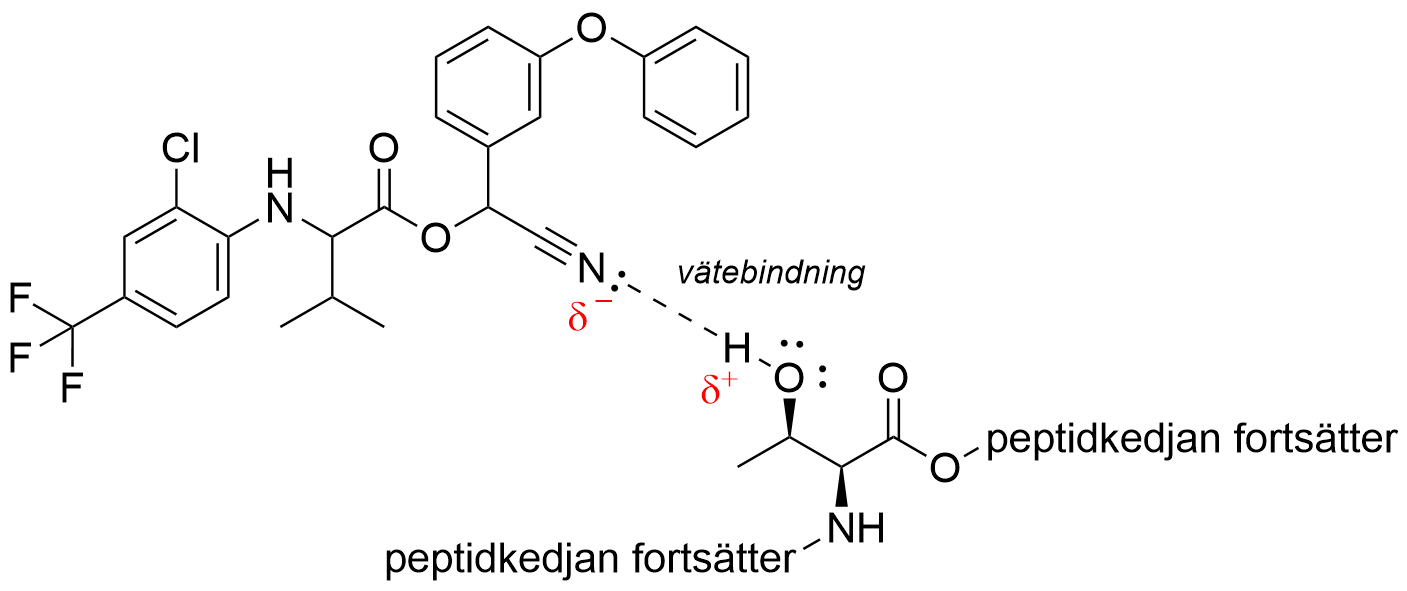
11.4 Pyretroiderna binds till de spänningsberoende Na⁺-kanalerna i insekter. De här kanalerna är till sin kemiska struktur proteiner. Bindningen inverkar på funktionen hos insekternas nervceller. Bindningen av fluvalinat till proteinet förstärks av cyanogruppen –C≡N. Cyanogruppen binds till en sidogrupp (sidokedja) i treonin, som är en del av polypeptidkedjan i proteinet. Strukturformeln för treonin visas invid. Hurdana svaga bindningar kan cyanogruppen bilda till sidogruppen i treonin? Motivera ditt svar. 5 p.
-
Om svaret beskriver starka bindningar, 0 p. för hela deluppgiften.
I treonins sidogrupp finns en hydroxigrupp (–OH). (1 p.)
-
Om övriga funktionella grupper omnämns som del av sidogruppen, 0 p.
Bindningen är en vätebindning/dipol-dipolbindning (1 p.)
Högst 3 p. kan ansamlas för följande ytterligare observationer:
-
Vätebindningen är mellan kväveatomen i cyanogruppen och väteatomen i –OH-gruppen. (2 p.)
-
Det krävs att bindningen är placerad rätt.
-
-
Vätebindningen bildas till elektronparet i cyanogruppens kväveatom. (1 p.)
-
Kväveatomen i cyanogruppen har en negativ delladdning. (1 p.)
-
Väteatomen i –OH-gruppen i treonin har en positiv delladdning. (1 p.)
-
Det förekommer också dispersionskrafter mellan cyanogruppen och sidokedjan i treonin. (1 p.)
-
Det kan bildas en dipol-dipolbindning mellan cyanogruppens kolatom och syreatomen i –OH-gruppen. (1 p.)
Vätebindningen mellan sidogruppen i treonin och fluvalinat (i svaret krävs ingen figur):